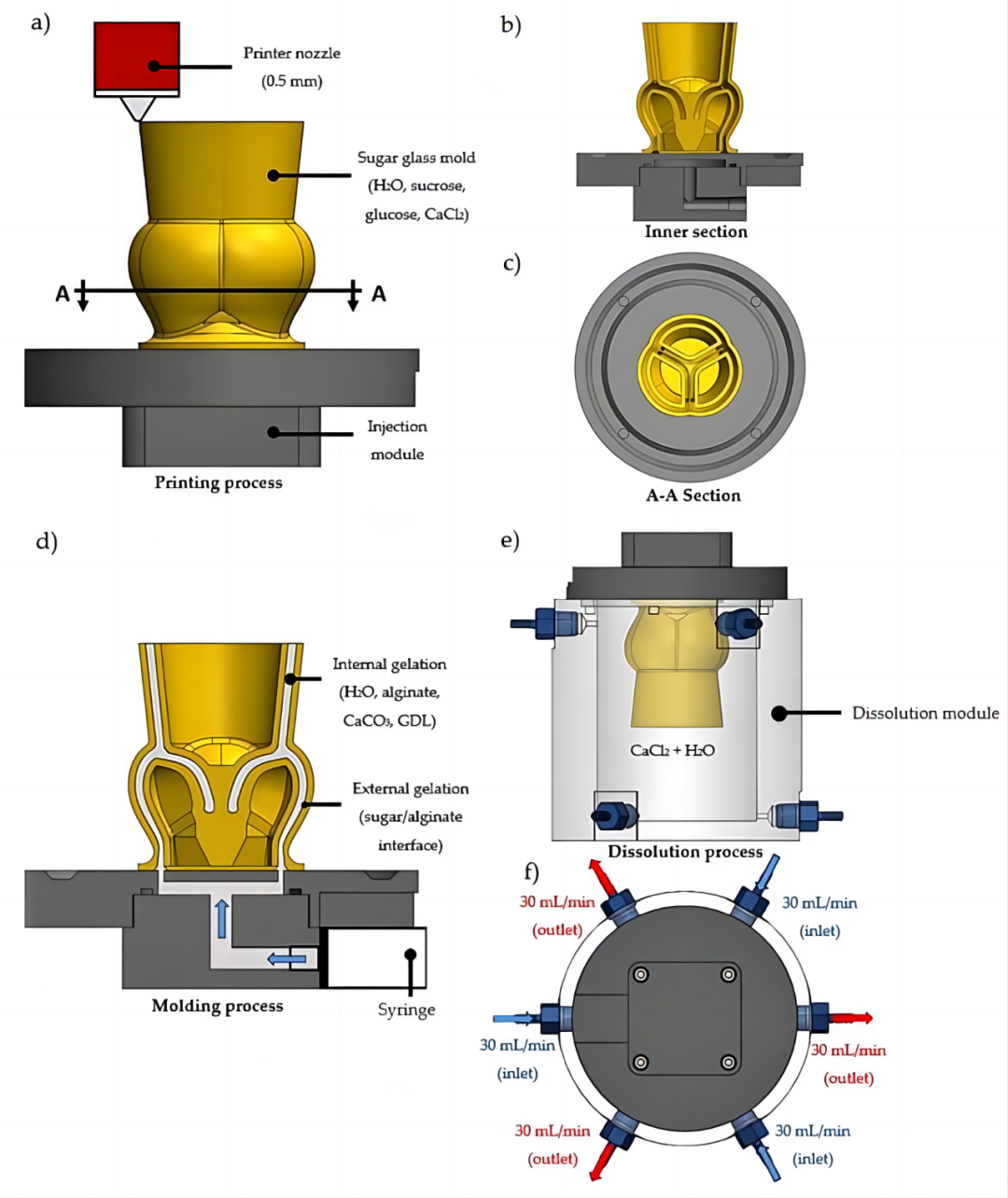
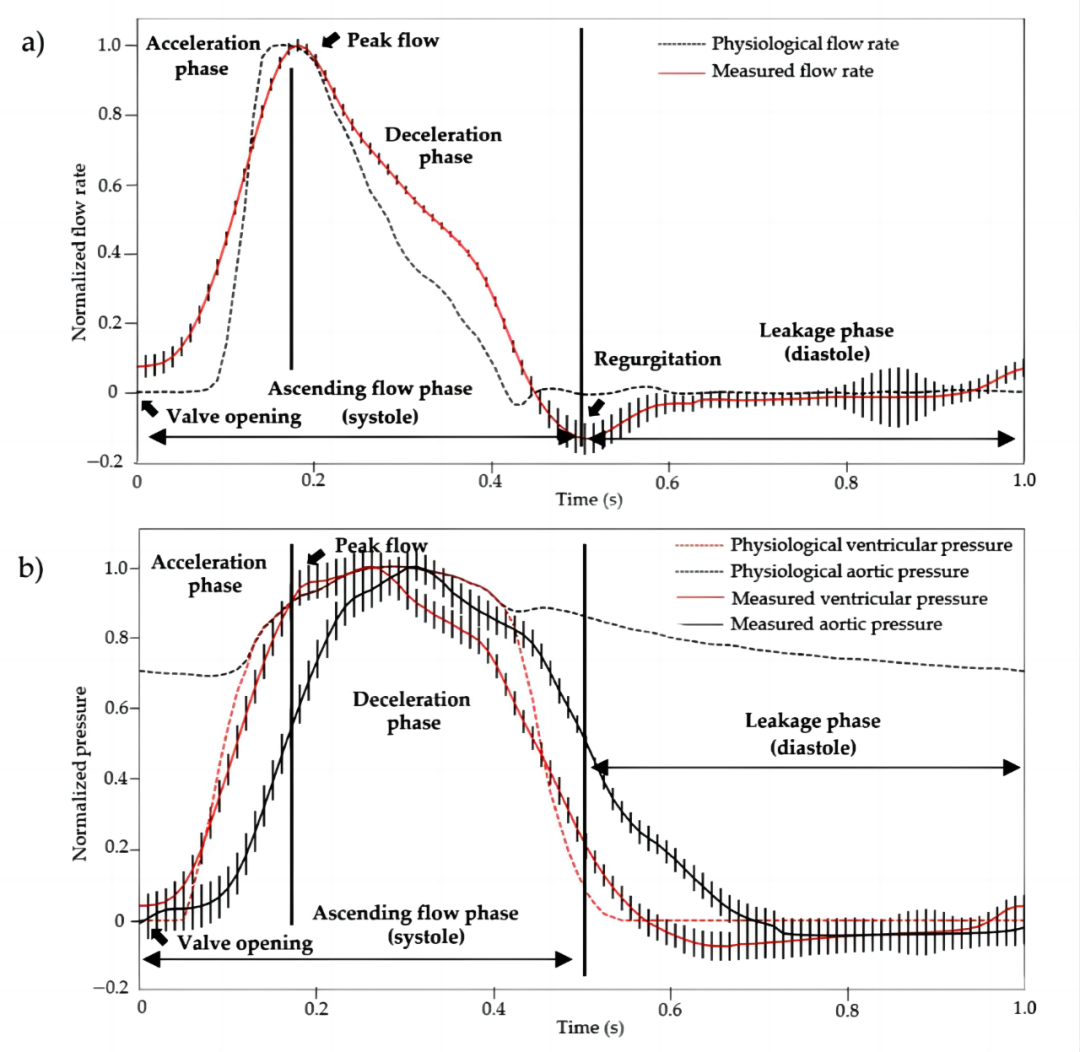
[1]. Kluin, J.; Talacua, H.; Smits, A.I.; Emmert, M.Y.; Brugmans, M.C.; Fioretta, E.S.; Dijkman, P.E.; Söntjens, S.H.; Duijvelshoff, R.; Dekker, S.; et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant—From material design to 12 months follow-up in sheep. Biomaterials 2017, 125, 101–117.
[2]. Uiterwijk, M.; Smits, A.I.; van Geemen, D.; van Klarenbosch, B.; Dekker, S.; Cramer, M.J.; van Rijswijk, J.W.; Lurier, E.B.; DiLuca, A.; Brugmans, M.C.; et al. In Situ Remodeling Overrules Bioinspired Scaffold Architecture of Supramolecular Elastomeric Tissue-Engineered Heart Valves. JACC Basic Transl. Sci. 2020, 5, 1187–1206.
[3]. Capulli, A.K.; Emmert, M.Y.; Pasqualini, F.S.; Kehl, D.; Caliskan, E.; Lind, J.U.; Sheehy, S.P.; Park, S.J.; Ahn, S.; Weber, B.; et al. JetValve: Rapid manufacturing of biohybrid scaffolds for biomimetic heart valve replacement. Biomaterials 2017, 133, 229–241. [
[4]. Soliman, O.I.; Miyazaki, Y.; Abdelghani, M.; Brugmans, M.; Witsenburg, M.; Onuma, Y.; Serruys, P.W. Midterm performance of a novel restorative pulmonary valved conduit: Preclinical results. EuroIntervention 2017, 13, e1418–e1427.
[5]. Duan, B.; Hockaday, L.A.; Kang, K.H.; Butcher, J.T. 3D Bioprinting of heterogeneous aortic valve conduits with alginate/gelatin hydrogels. J. Biomed. Mater. Res. Part A 2013, 101A, 1255–1264.
[6]. Matai, I.; Kaur, G.; Seyedsalehi, A.; McClinton, A.; Laurencin, C.T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials 2020, 226, 119536.
[7]. Lee, A.; Hudson, A.R.; Shiwarski, D.J.; Tashman, J.W.; Hinton, T.J.; Yerneni, S.; Bliley, J.M.; Campbell, P.G.; Feinberg, A.W. 3D bioprinting of collagen to rebuild components of the human heart. Science 2019, 365,482–487.
[8]. Fioretta, E.S.; Motta, S.E.; Lintas, V.; Loerakker, S.; Parker, K.K.; Baaijens, F.P.T.; Falk, V.; Hoerstrup, S.P.; Emmert, M.Y. Next generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nat. Rev. Cardiol. 2021, 18, 92–116
[9]. Mirani, B.; Nejad, S.P.; Simmons, C.A. Recent Progress Toward Clinical Translation of Tissue-Engineered Heart Valves. Can. J. Cardiol. 2021, 37, 1064–1077
[10]. Goecke, T.; Theodoridis, K.; Tudorache, I.; Ciubotaru, A.; Cebotari, S.; Ramm, R.; Höfflfler, K.; Sarikouch, S.; Rivera, A.V.; Haverich, A.; et al. In vivo performance of freeze-dried decellularized pulmonary heart valve allo- and xenografts orthotopically implanted into juvenile sheep. Acta Biomater. 2018, 68, 41–52.
[11]. Erdbrügger, W.; Konertz, W.; Dohmen, P.M.; Posner, S.; Ellerbrok, H.; Brodde, O.E.; Pauli, G. Decellularized xenogenic heart valves reveal remodeling and growth potential in vivo. Tissue Eng. 2006, 12, 2059–2068.
[12]. Dohmen, P.M.; Da Costa, F.; Lopes, S.V.; Yoshi, S.; Da Souza, F.P.; Vilani, R.; Da Costa, M.B.; Konertz, W. Results of a Decellularized Porcine Heart Valve Implanted into the Juvenile Sheep Model. Heart Surg. Forum 2005, 8, 100–104.
[13]. Stock, U.A.; Schenke-Layland, K. Performance of decellularized xenogeneic tissue in heart valve replacement. Biomaterials 2006, 27, 1–2.
[14]. Sarikouch, S.; Horke, A.; Tudorache, I.; Beerbaum, P.; Westhoff-Bleck, M.; Boethig, D.; Repin, O.; Maniuc, L.; Ciubotaru, A.; Haverich, A.; et al. Decellularized fresh homografts for pulmonary valve replacement: A decade of clinical experience. Eur. J. Cardio-Thoracic Surg. 2016, 50, 281–290.
[15]. Sarikouch, S.; Theodoridis, K.; Hilfifiker, A.; Boethig, D.; Laufer, G.; Andreas, M.; Cebotari, S.; Tudorache, I.; Bobylev, D.; Neubert, L.; et al. Early Insight Into In Vivo Recellularization of Cell-Free Allogenic Heart Valves. Ann. Thorac. Surg. 2019, 108,
581–589.
[16]. Lisy, M.; Kalender, G.; Schenke-Layland, K.; Brockbank, K.G.; Biermann, A.; Stock, U.A. Allograft Heart Valves: Current Aspects and Future Applications. Biopreserv. Biobank. 2017, 15, 148–157.
[17]. da Costa, F.D.; Costa, A.C.B.; Prestes, R.; Domanski, A.C.; Balbi, E.M.; Ferreira, A.D.; Lopes, S.V. The Early and Midterm Function of Decellularized Aortic Valve Allografts. Ann. Thorac. Surg. 2010, 90, 1854–1860.
[18]. Ebken, J.; Mester, N.; Smart, I.; Ramm, R.; Goecke, T.; Jashari, R.; Böthig, D.; Horke, A.; Cebotari, S.; Tudorache, I.; et al. Residual immune response towards decellularized homografts may be highly individual. Eur. J. Cardio-Thoracic Surg. 2021, 59, 773–782.
[19]. Wu, Z.; Su, X.; Xu, Y.; Kong, B.; Sun, W.; Mi, S. Bioprinting three-dimensional cell-laden tissue constructs with controllable degradation. Sci. Rep. 2016, 6, 24474.
[20]. Bégin-Drolet, A.; Collin, S.; Gosselin, J.; Ruel, J. A new robust controller for non-linear periodic single-input/single-output systems using genetic algorithms. J. Process Control 2018, 61, 23–35.