房性早搏消融:有待开拓的领域
2015-08-11 14:57
步入三维电生理时代,导管消融已经成为多种快速性心律失常的有效治疗手段。非持续性心律失常,如室性早搏(室早),也因可能导致心功能受损、触发心室颤动(室颤)等恶性心律失常而得到充分重视,室早导管消融已成为有效的根治手段,目前已经形成消融适应症、心电图定位、导管标测等较完善的方法学。然而,另一种非持续性心律失常——房性早搏(简称房早),人们却未引起应有的重视。
房早是临床非常常见的心律失常,据瑞士学者Conen D等[1]对1742名年龄大于50岁的人群横断面调查发现,房早的发生率随着年龄增加而增加,按年龄段将人群分为50~55岁、55~60岁、60~65岁、65~70岁和70岁以上五组,各组每小时平均房早个数分别为0.8,1.1,1.4,2.3和2.6(P<0.0001),仅1.8%的患者24h Holter未发现房早。房早的发生频率与合并心血管疾病、血脂水平等因素相关。
多项临床研究表明,除引起心慌、胸闷、头晕、乏力等不适症状外,频发房早(>100/天)是导致心房颤动(房颤)的危险因素,并与脑卒中和死亡率增加相关。Binici Z等[2]发现,过多的房早(>30/h,或>20阵/小时)与初级复合终点(卒中和死亡率)增加相关(危险比 1.64,95%可信限1.03~2.60,P=0.036),与房颤住院(危险比2.78,95%可信限1.08~6.99,P=0.033) 和卒中相关 (危险比2.79,95%可信限1.23~6.30,P=0.014)。Chong BH等[3]对428例既往无房颤和心血管病史的人群进行Holter检查,平均随访6.1年发现,频发房早者的房颤发生率为29%,而无频发房早者的房颤发生率为9%(P<0.01)。Cox回归发现频发房早(危险比 3.22,95%可信限1.9~5.5,P<0.001)、年龄>75岁(危险比2.3,95%可信限1.3~3.9; P= 0.004)和冠心病(危险比2.5,95%可信限1.4~4.4,P=0.002)是房颤的独立预测因子。与频发室早类似,Hasdemir C等[4]报道频发房早可导致心脏扩大、心动过速性心肌病,房早消融根治后,心脏扩大逆转、心功能改善。此外,尚有频发房早触发病变Purkinje纤维内的折返,导致室速室颤的[5]。频发房早也可能伴随某些生理活动而出现,如吞咽活动相关的心律失常。有文献报道起源于右心耳的房早未下传导致显著的心动过缓。由此可见房早不是无害的心律失常,它可能导致房颤、造成卒中和死亡率增加,切不可等闲视之。
常规药物治疗频发房早多可见效,但对部分患者无效或不能耐受。理论上导管消融可以治疗,但房性异位P’波受T波影响较难识别,因而不易判定房早系单源或多源。迄今为止房早消融文献报道较少,Yamada T等[6]较早描述了CARTO引导非肺静脉起源房早的标测方法,此外,Tada H等[7]报道了两例Ensite非接触球囊标测房早,说明三维标测系统引导房早消融治疗是可行和有效的。
笔者所在上海交通大学心律失常诊治中心(仁济医院东院)自2012年3月至2014年12月底共对25例频发房早短阵房速(不合并房颤)患者进行三维系统引导下的导管消融术。其中男性7例,女性18例。平均年龄45.1±17.4岁,平均24h房早数为25, 371±10,908个,合并的短阵房速数为638±458阵,平均病程34.6±27.9个月。平均左房内径36.0±4.3mm。合并高血压8例,冠心病、陈旧性心肌梗死1例。采用CARTO系统引导23例,Ensite-Velosity系统引导2例。
标测方法:在局麻下进行电生理检查,房早、短阵房速自发或予异丙肾上腺素(10~20ug/min)静脉滴注诱发。根据房早体表心电图P’波形态和冠状窦A波顺序初步判断房早起源。三维激动标测采用CARTO系统或Ensite-Velosity系统引导。经锁骨下静脉放置10极冠状窦电极,选取冠状窦A波稳定的电极对作为参考电极。考虑左房起源行一次房间隔穿刺送入标测导管,诊断肺静脉起源则需要经两次房间隔穿刺,送入环状电极判断肺静脉电位的提前程度及其与心房波的相互关系。非肺静脉起源采用逐点标测方法,标测时根据P’波形态和冠状窦所有电极对A波顺序的异同,排除导管机械刺激导致的房早房速(图1)。
消融策略:对非肺静脉起源房早采用局灶消融,肺静脉起源房早采用同侧环肺静脉电隔离。消融采用盐水灌注射频导管进行,功率30~35W,盐水流速17~20ml/min。消融终点为临床型房早消失,静脉滴注异丙肾上腺素观察30min无相同类型房早出现。肺静脉起源者则需要保证“罪犯”肺静脉完全电隔离状态。
术后随访和疗效的评价标准:术后停用所有抗心律失常药物。消融术后1~3个月随访24h-Holter,评价24h房早频度。
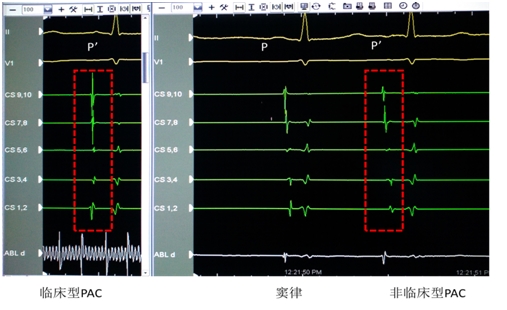
图1 标测和识别临床型房早从上到下为体表II、V1导联,CS 9,10~CS1,2和ABL电极记录。从左往右依次是临床型房早、窦律和非临床型房早。注意临床型和非临床型房早P波形态和心腔内激动顺序的不同
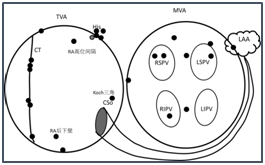
图2房早起源点的解剖分布图
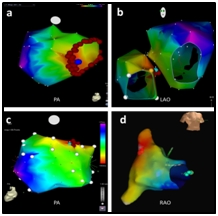
图3显示不同部位起源房早三维激动图。1例(图2d)界嵴中上部频发房早消融成功后(红色消融点),自发频发室早,标测提示室早起源于右侧希氏束旁,成功消融(浅蓝色消融点)。
主要随访结果:术后平均随访9.1±2.7(6~13)个月,25例中22例末次Holter随访显示房早均<50~100个/24h(未服用抗心律失常药物),一例术前有少量室早患者(1200/24h)术后室早5749个(口服普罗帕酮控制室早);3例术后房早频度与术前类似,包括2例术中即刻失败患者和1例起源于左上肺静脉患者。
讨论:频发房早除了引起胸闷、心悸等不适症状、影响生活质量,尚可能造成房颤和脑卒中发生率上升,因此不是完全良性的心律失常。临床上常规采用IC类抗心律失常药物和Beta阻滞剂治疗,但部分患者药物无效或不能耐受,因此探索射频消融治疗具有积极意义。
本研究初步证实房早异位灶分布具有一定的规律性,导管消融治疗频发房早是安全有效的。房早导管消融的难度在于术前预测和术中标测技术。由于房早P’波受T波干扰不易识别,术前判断房早局灶起源和数目具有一定难度。显而易见,多源性房早、紊乱性房速不适合消融治疗。本组小样本研究说明,无明显器质性心脏病的房早多为单源性,且其分布具有规律性,多分布于于固定的解剖结构周围,如界嵴、His束旁、肺静脉、瓣环,其余部位少见。此外,同样由于房早P’波振幅相对较小,房早标测技术上需要区分临床型和非临床型房早。对此,本研究采用体表ECG的P’形态结合心腔内多部位多导标测的方法,能有效识别临床型室早。当然,若采用EnSite-Array非接触标测技术或许能更快捷、更准确地标测房早局灶。房早消融并无特别之处,除了位于His束旁有损伤传导系统风险之外,其余部位消融并无特别风险。与房颤消融类似,环肺静脉消融也存在肺静脉电位恢复的可能性,从而导致房早复发。
结语:无明显器质性心脏病的房早异位灶分布具有一定的规律性,对于药物治疗无效的频发房早,三维标测引导下导管消融方法可行、疗效较好,值得进一步研究。
多项临床研究表明,除引起心慌、胸闷、头晕、乏力等不适症状外,频发房早(>100/天)是导致心房颤动(房颤)的危险因素,并与脑卒中和死亡率增加相关。Binici Z等[2]发现,过多的房早(>30/h,或>20阵/小时)与初级复合终点(卒中和死亡率)增加相关(危险比 1.64,95%可信限1.03~2.60,P=0.036),与房颤住院(危险比2.78,95%可信限1.08~6.99,P=0.033) 和卒中相关 (危险比2.79,95%可信限1.23~6.30,P=0.014)。Chong BH等[3]对428例既往无房颤和心血管病史的人群进行Holter检查,平均随访6.1年发现,频发房早者的房颤发生率为29%,而无频发房早者的房颤发生率为9%(P<0.01)。Cox回归发现频发房早(危险比 3.22,95%可信限1.9~5.5,P<0.001)、年龄>75岁(危险比2.3,95%可信限1.3~3.9; P= 0.004)和冠心病(危险比2.5,95%可信限1.4~4.4,P=0.002)是房颤的独立预测因子。与频发室早类似,Hasdemir C等[4]报道频发房早可导致心脏扩大、心动过速性心肌病,房早消融根治后,心脏扩大逆转、心功能改善。此外,尚有频发房早触发病变Purkinje纤维内的折返,导致室速室颤的[5]。频发房早也可能伴随某些生理活动而出现,如吞咽活动相关的心律失常。有文献报道起源于右心耳的房早未下传导致显著的心动过缓。由此可见房早不是无害的心律失常,它可能导致房颤、造成卒中和死亡率增加,切不可等闲视之。
常规药物治疗频发房早多可见效,但对部分患者无效或不能耐受。理论上导管消融可以治疗,但房性异位P’波受T波影响较难识别,因而不易判定房早系单源或多源。迄今为止房早消融文献报道较少,Yamada T等[6]较早描述了CARTO引导非肺静脉起源房早的标测方法,此外,Tada H等[7]报道了两例Ensite非接触球囊标测房早,说明三维标测系统引导房早消融治疗是可行和有效的。
笔者所在上海交通大学心律失常诊治中心(仁济医院东院)自2012年3月至2014年12月底共对25例频发房早短阵房速(不合并房颤)患者进行三维系统引导下的导管消融术。其中男性7例,女性18例。平均年龄45.1±17.4岁,平均24h房早数为25, 371±10,908个,合并的短阵房速数为638±458阵,平均病程34.6±27.9个月。平均左房内径36.0±4.3mm。合并高血压8例,冠心病、陈旧性心肌梗死1例。采用CARTO系统引导23例,Ensite-Velosity系统引导2例。
标测方法:在局麻下进行电生理检查,房早、短阵房速自发或予异丙肾上腺素(10~20ug/min)静脉滴注诱发。根据房早体表心电图P’波形态和冠状窦A波顺序初步判断房早起源。三维激动标测采用CARTO系统或Ensite-Velosity系统引导。经锁骨下静脉放置10极冠状窦电极,选取冠状窦A波稳定的电极对作为参考电极。考虑左房起源行一次房间隔穿刺送入标测导管,诊断肺静脉起源则需要经两次房间隔穿刺,送入环状电极判断肺静脉电位的提前程度及其与心房波的相互关系。非肺静脉起源采用逐点标测方法,标测时根据P’波形态和冠状窦所有电极对A波顺序的异同,排除导管机械刺激导致的房早房速(图1)。
消融策略:对非肺静脉起源房早采用局灶消融,肺静脉起源房早采用同侧环肺静脉电隔离。消融采用盐水灌注射频导管进行,功率30~35W,盐水流速17~20ml/min。消融终点为临床型房早消失,静脉滴注异丙肾上腺素观察30min无相同类型房早出现。肺静脉起源者则需要保证“罪犯”肺静脉完全电隔离状态。
术后随访和疗效的评价标准:术后停用所有抗心律失常药物。消融术后1~3个月随访24h-Holter,评价24h房早频度。

图1 标测和识别临床型房早从上到下为体表II、V1导联,CS 9,10~CS1,2和ABL电极记录。从左往右依次是临床型房早、窦律和非临床型房早。注意临床型和非临床型房早P波形态和心腔内激动顺序的不同
主要消融结果:25例患者均完成三维标测和消融,。平均手术时间93.4±27.2(50~130)min,平均X线透视时间15.1±7.6(6~28)min,平均三维电生理标测时间16.5±6.1(10~28)min。三维标测发现25例患者的房早均为单一部位起源,房早起源部位的解剖分布见图2。25个房早异位灶中,10个(40%)位于左房, 其中6个位于肺静脉及前庭,另4个分别位于左房顶部、左心耳口、左房后下壁和二尖瓣环;15个(60%)位于右房,其中6个位于界嵴,4个位于His旁,2个位于三尖瓣环,位于Kock三角、右房高位间隔和后下壁各1例。并发症:1例Koch三角起源房早术后出现血胸,经胸腔穿刺引流治疗成功。
术中即刻结果:25例患者,即刻成功23例。肺静脉(前庭)起源房早6例患者中, 3例经环右肺静脉隔离成功消除,3例经环左肺静脉成功消除1例(另2例经肺静脉口外局灶消融成功)。其余17例非肺静脉局灶起源患者消融成功。
共计2例消融失败,其中1例起源于His束旁(因His损伤风险无法有效放电)和1例右房后下壁房早消融失败。
术中即刻结果:25例患者,即刻成功23例。肺静脉(前庭)起源房早6例患者中, 3例经环右肺静脉隔离成功消除,3例经环左肺静脉成功消除1例(另2例经肺静脉口外局灶消融成功)。其余17例非肺静脉局灶起源患者消融成功。
共计2例消融失败,其中1例起源于His束旁(因His损伤风险无法有效放电)和1例右房后下壁房早消融失败。

图2房早起源点的解剖分布图

图3显示不同部位起源房早三维激动图。1例(图2d)界嵴中上部频发房早消融成功后(红色消融点),自发频发室早,标测提示室早起源于右侧希氏束旁,成功消融(浅蓝色消融点)。
主要随访结果:术后平均随访9.1±2.7(6~13)个月,25例中22例末次Holter随访显示房早均<50~100个/24h(未服用抗心律失常药物),一例术前有少量室早患者(1200/24h)术后室早5749个(口服普罗帕酮控制室早);3例术后房早频度与术前类似,包括2例术中即刻失败患者和1例起源于左上肺静脉患者。
讨论:频发房早除了引起胸闷、心悸等不适症状、影响生活质量,尚可能造成房颤和脑卒中发生率上升,因此不是完全良性的心律失常。临床上常规采用IC类抗心律失常药物和Beta阻滞剂治疗,但部分患者药物无效或不能耐受,因此探索射频消融治疗具有积极意义。
本研究初步证实房早异位灶分布具有一定的规律性,导管消融治疗频发房早是安全有效的。房早导管消融的难度在于术前预测和术中标测技术。由于房早P’波受T波干扰不易识别,术前判断房早局灶起源和数目具有一定难度。显而易见,多源性房早、紊乱性房速不适合消融治疗。本组小样本研究说明,无明显器质性心脏病的房早多为单源性,且其分布具有规律性,多分布于于固定的解剖结构周围,如界嵴、His束旁、肺静脉、瓣环,其余部位少见。此外,同样由于房早P’波振幅相对较小,房早标测技术上需要区分临床型和非临床型房早。对此,本研究采用体表ECG的P’形态结合心腔内多部位多导标测的方法,能有效识别临床型室早。当然,若采用EnSite-Array非接触标测技术或许能更快捷、更准确地标测房早局灶。房早消融并无特别之处,除了位于His束旁有损伤传导系统风险之外,其余部位消融并无特别风险。与房颤消融类似,环肺静脉消融也存在肺静脉电位恢复的可能性,从而导致房早复发。
结语:无明显器质性心脏病的房早异位灶分布具有一定的规律性,对于药物治疗无效的频发房早,三维标测引导下导管消融方法可行、疗效较好,值得进一步研究。
参考文献
1.Conen D, Adam M, Roche F, et al. Premature atrial contractions in the general population: frequency and risk factors. Circulation. 2012;126:2302-2308
2.Binici Z, Intzilakis T, Nielsen OW, et al. Excessive supraventricular ectopic activity and increased risk of atrial fibrillation and stroke. Circulation. 2010;121:1904-1911.
3.Chong BH, Pong V, Lam KF, et al. Frequent premature atrial complexes predict new occurrence of atrial fibrillation and adverse cardiovascular events. Europace. 2012;14:942-947.
4.Hasdemir C, Simsek E, Yuksel A. Premature atrial contraction-induced cardiomyopathy. Eoropace. 2013;doi:10.1093/europace/eut141
5.Hzuka T, Kaneko Y, Nakajima T, et al. Idiopathic ventricular fibrillation triggered by premature atrial complexes. J Cardiovasc Electrophysiol.2014; doi:10.1111/jce.12545
6.Yamada T, Murakami Y, Okada T, et al. Electroanatomic mapping in the catheter ablation of premature atrial contractions with a non-pulmonary vein origin. Europace.2008;10:1320-1324
7.Tada H, Kaseno K, Naito S, et al. Non-contact three-dimensional mapping and ablation of swallowing-induced atrial tachyarrhythmias: two casw reports. J CardiovascElectrophysiol. 2007;18:1206-1209
1.Conen D, Adam M, Roche F, et al. Premature atrial contractions in the general population: frequency and risk factors. Circulation. 2012;126:2302-2308
2.Binici Z, Intzilakis T, Nielsen OW, et al. Excessive supraventricular ectopic activity and increased risk of atrial fibrillation and stroke. Circulation. 2010;121:1904-1911.
3.Chong BH, Pong V, Lam KF, et al. Frequent premature atrial complexes predict new occurrence of atrial fibrillation and adverse cardiovascular events. Europace. 2012;14:942-947.
4.Hasdemir C, Simsek E, Yuksel A. Premature atrial contraction-induced cardiomyopathy. Eoropace. 2013;doi:10.1093/europace/eut141
5.Hzuka T, Kaneko Y, Nakajima T, et al. Idiopathic ventricular fibrillation triggered by premature atrial complexes. J Cardiovasc Electrophysiol.2014; doi:10.1111/jce.12545
6.Yamada T, Murakami Y, Okada T, et al. Electroanatomic mapping in the catheter ablation of premature atrial contractions with a non-pulmonary vein origin. Europace.2008;10:1320-1324
7.Tada H, Kaseno K, Naito S, et al. Non-contact three-dimensional mapping and ablation of swallowing-induced atrial tachyarrhythmias: two casw reports. J CardiovascElectrophysiol. 2007;18:1206-1209