
2022年11月(总第4期)
作者:毛予、翟蒙恩、刘洋、杨剑
Highlight
本文亮点:

1)将患者特定的影像数据进行3D打印可以实现复杂的心血管解剖结构可视化;
2)心血管3D打印技术的常用成像方式是心脏计算机断层扫描和心脏磁共振扫描;
3)材料喷射/聚射和立体光刻打印技术是目前较为广泛应用的3D打印技术;
4)当前背景下,仍需要标准化验证方法来比较不同的3D打印技术。
////////////////////////////////////////
3D打印技术即增材制造技术(Additive manufacturing,AM),是一种将医学影像数据转换形成实物模型的新兴技术。通过3D打印患者特定医学影像(3D printed patient-specific phantoms,3DPSPs),从而实现将复杂的心血管解剖结构可视化,并提供逼真的触觉反馈,以指导完成手术规划、制定诊疗措施以及年轻医生的个性化培训。与此同时,后处理的进步引起了人们的兴趣,已有多项研究报道了应用3DPSPs。一般而言,3DPSPs的制造过程包括图像采集及后处理,直接/间接AM以及3D打印模型的验证。目前,3D打印技术在其他应用领域的3DPSPs研究中大多是模仿真实解剖结构的生物制造(例如整形外科手术)以及仿真人体软组织特性(例如皮肤表面纹理、可穿刺性和弹性等)。然而,由心动周期引起的心脏解剖结构的几何变化构成了心血管3DPSPs的一个重要挑战。截至目前,可应用于心血管3DPSPs的柔性材料并不多,并且业界在成像方式、印刷技术和材料的最佳选择上尚未达成明确共识。但是,新研究开发的材料、改进的3D打印技术以及先进的后处理方式会帮助研究者们克服其中的一些壁垒。本系统综述系统分析了心血管3DPSPs生产的整个过程,包括成像,材料、打印以及模型验证。此外,还针对当前心血管3DPSPs的局限性以及对改善3D打印模型组织特性的未来方向提出了科学的见解。

图1 心血管3DPSPs的具体制造过程主要包括:成像(主要使用心脏计算机断层扫描和心脏磁共振扫描)、打印(通常使用PolyJet打印技术)和模型验证。
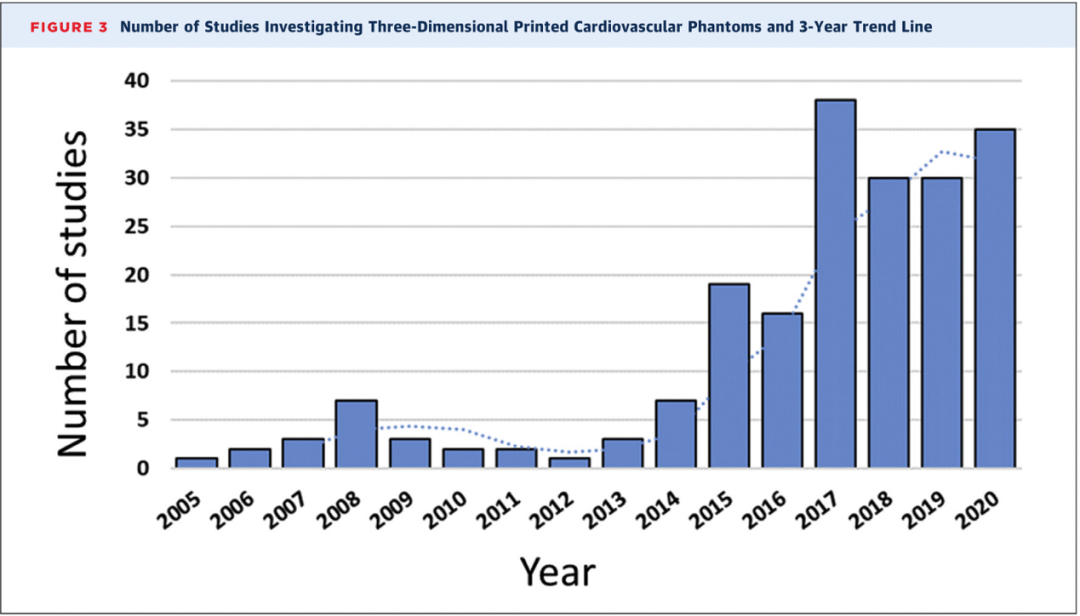
图2 作者对2005年至2020年的心血管3D打印研究成果进行了分析。可以看到自2017年起,每年心血管3DPSP文献数量均达到30篇或以上,间接说明了心血管3D打印技术在现代心血管疾病的精准诊疗中发挥了不可替代的作用。

图3 介绍了当前主流的心血管3D打印技术,包括材料喷射打印技术(左上)、立体光刻打印技术(右上)、熔融沉积成型技术(右中)、粉末床熔融技术(左下)、喷胶粘粉成型技术(右下)。
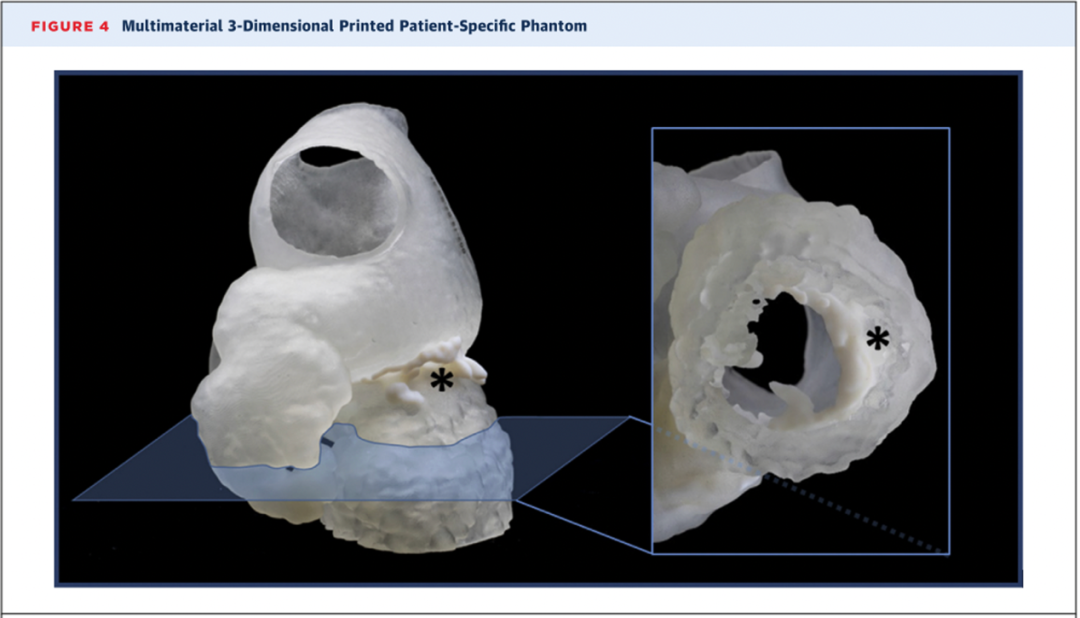
图4 该模型为基于心脏计算机断层扫描的左心房和主动脉根部的多材料模型,包括通过PolyJet打印的二尖瓣瓣环钙化部分(标注为星号),其材料使用的是Agilus30透明材料和Vero纯白色材料形成的混合物。
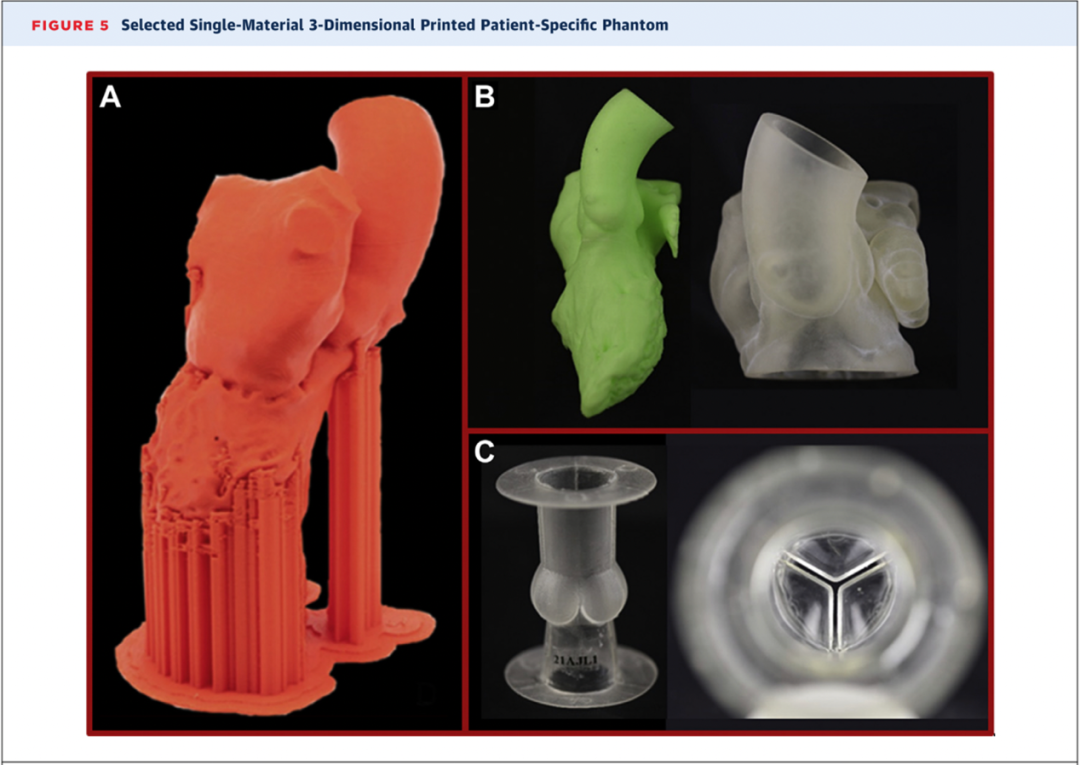
图5 单材料心血管3DPSP模型。(A)基于心脏计算机断层扫描的熔融沉积的心血管模型。(B)基于心脏计算机断层扫描的心脏3DPSP模型,绿色模型采用熔融沉积成型技术,半透明模型为PolyJet打印。(C)由熔融沉积成型技术打印的硅酮主动脉根部模型。
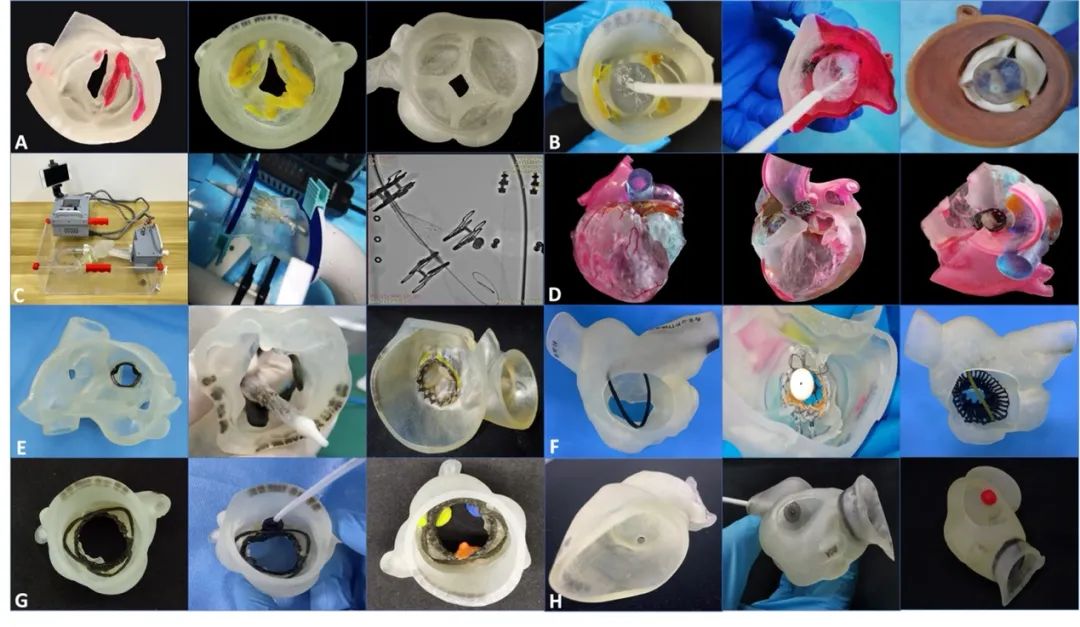
图6 西京医院心外科TAVR团队自2016年至今,已完成3D打印辅助下各类手术近千例,将3D打印技术普遍应用于术前影像评估和手术规划,大大提高了手术安全性和成功率。(A)打印术前主动脉根部模型观察瓣叶形态以及与毗邻结构关系。(B)术前TAVR体外模拟预估并发症。(C)采用TAVR脉动流模拟器逼真条件下进行模拟评估。(D)术后打印多彩多材料模型验证TAVR手术效果。(E)打印左心模型并行TMVR模拟测试。(F)打印右心模型并行TTVR模拟测试。(G)打印主动脉根部模型并行PVL封堵模拟测试。(H)打印主动脉及根部模型并行吻合口瘘封堵模拟测试。
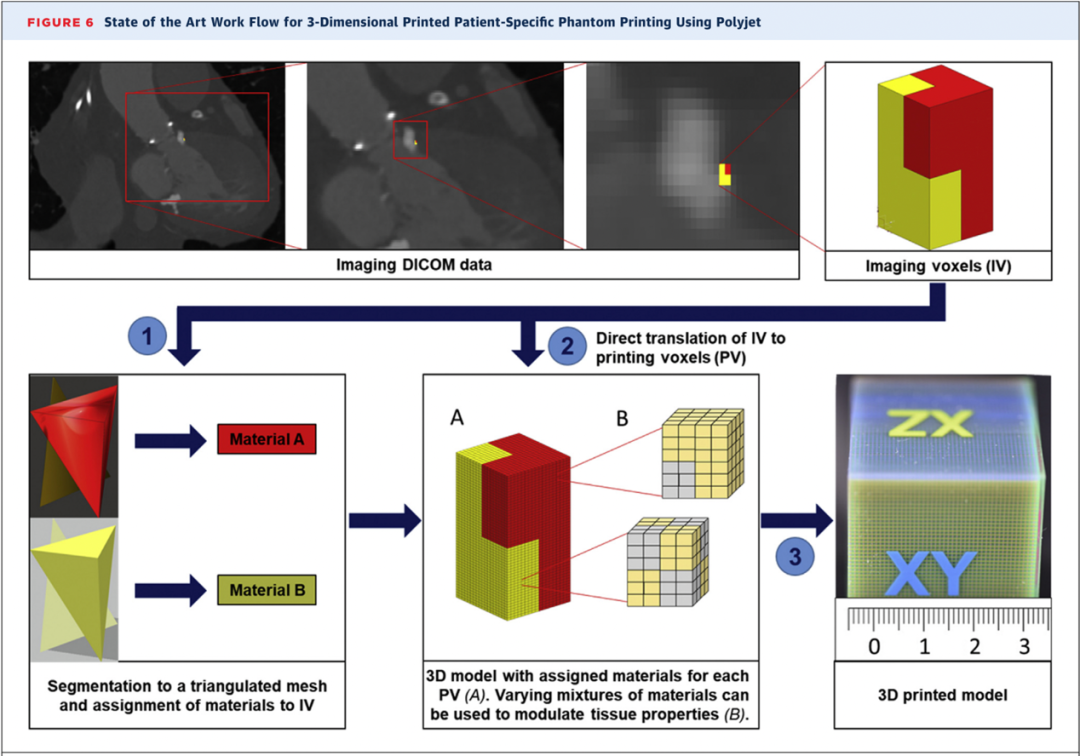
图7 使用PolyJet打印心血管3DPSP模型的最新工作流程。在设定合适衰减值的基础上,工程师在感兴趣区域中设置针对不同组织的不同掩模。心肌组织(红色)和主动脉瓣环形钙化部分(黄色)被体素分割并完成网格化处理。随后,将特定的材料分配给之前已分割好的体素类型;例如,将钙化结构标记为黄色而将心肌组织标记为红色。最后,运用专业软件将模型切片并将其输入为打印机指令。
结论与下步展望
心血管3D打印技术为当前的疾病诊疗和临床应用提供了足够的解剖精度,尤其体现在心血管疾病诊疗规划、指导和制定以及相关专业人员的培训教学中。当前,由于对心血管3D模型的要求是需要尽可能贴近人体解剖结构和功能变化,因此无论是成像方式、打印技术、材料选择抑或是其模型验证,亟待得到进一步提升与完善:1)在未来,高精度的3D打印设备或许能实现生产个性化的3D打印器械(例如血管支架等)。到目前为止,生物相容性是生产可植入3D打印器械的一个重要禁锢,未来也许可以通过引入新材料或常规3D打印和生物打印的组合来改善可植入3D打印器械的材料设计问题。2)心血管3DPSPs在未来进一步的发展方向可能是动态的3D打印模型。该模型可实现心动周期从而无限贴近人体真实生理的复杂解剖结构和功能变化,而体素打印(Voxel printing,VP)技术在这方面非常有前途。与只能局限于预定义材料的技术相比,VP允许将材料单独分配给各个成像体素。因此,各组织特征可以直接转换为体素打印而无需事先分割;即使高分辨率成像中的成像体素(大多数情况下空间分辨率设置约为1mm)远大于打印体素(空间分辨率约为80mm),打印材料也可在微观水平上不断调整以获得所需的组织特性。截至目前,VP仅与PolyJet打印机兼容,虽然尚不能用于临床心血管疾病的诊疗中,但提供的3DPSPs具有类似于人体组织的解剖几何和机械性能。此外,VP需要大量医工方面的投入,强调需要不断加强临床医生、影像专家和技术工程师之间的沟通以促进心血管3D打印技术进一步发展。

扫码查看原文

专家简介
杨剑
空军军医大学西京医院
心血管外科一病区主任,博士研究生导师。曾于德国洪堡大学Charité医学院、德国柏林心脏中心、美国Cleveland Clinic医学中心等国际知名医学中心访问研修。担任美国心脏协会专家会员(FAHA)、 美国心脏病学会专家会员(FACC)、中国医师协会心血管外科医师分会结构性心脏病专业委员会副主任委员、中华医学会胸心血管外科分会第九届委员会青年委员、陕西省医疗器械不良事件监测专家咨询评价委员会专家。获聘陕西省中青年科技创新领军人才、陕西省科技创新团队带头人,为陕西省自然科学基础研究计划杰出青年科学基金项目获得者、西安交通大学兼职教授。担任Eur Heart J, BMJ,AJC等杂志特邀审稿人,《中华胸心血管外科杂志》、《心脏杂志》、《中国体外循环杂志》、《心血管外科杂志》、《精准医学杂志》编委。临床专长于复杂结构性心脏病的微创及介入治疗,在国内较先开展了经导管肺动脉瓣置换、主动脉瓣置换、二尖瓣修复、二尖瓣置换以及瓣周漏封堵等创新性技术。主要科研方向为结构性心脏病诊疗新技术以及心肌细胞损伤修复、重构和再生的临床转化研究。在微创心血管器械研发、临床转化及以3D打印为主的多模态影像学评估方面有一定建树。先后在Eur Heart J,JACC等国际期刊上以第一或通讯作者发表SCI论文30余篇,被Circulation,JACC等国际权威杂志引用500次,承担十三五国家重点研发计划、国家自然科学基金等10余项基金,经费1000余万元。荣获国家科技进步二等奖、中华医学科技一等奖、中华医学会胸心血管外科分会Lillehei奖学金“菁英奖”、中国医师协会胸心血管外科分会优秀青年医师“杏林奖”等奖励。授权国家专利20余项,出版专著、译著12部。
刘洋
空军军医大学西京医院
博士,副主任医师,副教授,硕士研究生导师。美国马里兰大学医学院博士后。
国家心血管病专家委员会微创心血管外科专业委员会委员。专注心血管疾病微创治疗。先后开展经皮微创介入瓣膜病修复及置换术,瓣膜置换术后瓣周漏介入封堵术,主动脉缩窄球囊扩张支架置入术,冠状动脉漏介入封堵术等多项心血管疾病微创治疗新技术。在国内外发表研究论著50余篇,其中SCI论著21篇;主持军队重大专项子课题1项,国家自然科学基金1项,军队及省部级课题各7项;参加 “十二五”、“十三五”国家重大科技专项等课题13项。获国家专利20项;主编专著1部,副主编2部,参编专著8部。先后获得美国ASAIO青年医师奖,Euro-ELSO青年研究者奖,中国医师协会心血管外科分会杏林奖,中华医学会胸心血管外科分会Lillehei 奖学金及厄尔巴肯奖学金。

