
从历史的角度看问题:“网红”王十七的人工心脏背后经历了怎样的发展历程?
“给大家看点好东西,就是这个,中国第一颗(批)人工心脏。”
今年10月,随着脱口秀大会第五季的播出,演员王十七带着一个黑盒子,掀开一角,露出一条连接人工心脏的电线,第一次向大众讲述了他如何靠着电流维持生命的故事,让大家看到了一种没有心跳却能像正常人一样生活的“另类”状态。
之后,#听不到心跳还能正常生活#等话题登上微博热搜,人工心脏一时间成为大众热议的话题之一。

图源网络
然而,很少有人知道,王十七植入的这颗“中国心”就是来自苏州同心医疗的新一代全磁悬浮植入式心室辅助系统——慈孚®VAD(Ventricular Assist Device)。更鲜有人知道,从老一代搏动式LVAD(Left Ventricular Assist Device)发展到今天的全磁悬浮LVAD,这场技术迭代史不到30年。
同心医疗致力于独立研发、生产及销售具有技术突破性的心室辅助装置(LVAD),在推动技术发展的同时,也在积极协同本领域内的全球优势资源,促进国际学术交流和LVAD疗法推广,推动LVAD行业的创新和发展。2022年11月30日,由同心医疗牵头举办的“同伴PARTNER:同心医疗LVAD研讨沙龙”以线上直播的形式顺利举行。本次沙龙研讨会有幸邀请到来自INTEGRIS Baptist Medical Center的Dr. James W. Long以“LVAD产品的技术路径演变以及全磁悬浮LVAD的优势”为主题展开分享。

血泵
心脏毕竟是个极为复杂的器官,自然界花了千百万年才使心脏达到最佳状态。对人类而言,设计一个人工心脏,需要克服的技术难点超乎想象。所以,人工心脏被誉为医疗器械“皇冠上的明珠”,是一个国家高端医疗器械科技水平的标志之一。
不过,血液循环概念的提出使得临床医生们了解到,心脏对人体最重要的功能不在于跳动,而是实现泵血功能,最终促进全身血液的循环。从模仿动作到追求功能,全球医学界对于人工心脏的需求已经不是简单的解决“有没有”的问题,更重要的是要解决效果够不够好、是否先进的问题。
由此,近30年来LVAD迭代过程,也是科学家们对“血泵”的完善过程。

在未进入正题之前,首先需要注意的是:Dr. James W. Long所阐述的LVAD30年历史是以1994年首个被美国FDA批准的植入式左心室装置的首例人体应用为起点,并以此为脉络。之前其它科学家、心脏专家所做的早期探索并未列入其中。
Dr. James W. Long开场即谈到,老一代心室辅助装置(LVAD)HeartMate IP属于搏动式LVAD,采用气动式驱动,经临床试验证实HeartMate IP可以有效延长患者的生存时间,这也提示我们通过心室辅助装置可以实现有效延长患者生存期甚至长期治疗的可能。

HeartMate IP虽然在当时拯救了很多患者的生命,但其装置本身的耐久性较差,在泵血过程中对血液的损伤较大,导致较高比例的血栓形成、中风等严重不良事件,且装置笨重而不便携带,手术侵犯性较高,经皮管道易引起感染,这些因素都成为患者长期携带的障碍。当时的Dr. James W. Long就确定了还需要继续研究出新一代设备,改善临床治疗结局,使人工心脏可以应用于心衰患者的长期治疗。
上世纪80年代后期,由“旋转式人工心脏之父”Richard Wampler发明的Hemopump首次用于临床,开启了现代人工心脏的历史。现代人工心脏革命性地改变了设计理念,不再模仿心脏的动作,改而直接追求心脏的泵血的功能,由此产生了“旋转式人工心脏”。旋转式人工心脏采用一个刚性的带有叶片的叶轮,通过一定的支承机构置于完全密闭的泵壳内,叶轮旋转而将血液从泵的入口输送到出口,完成泵功能。随着旋转式人工心脏展示出全面的性能优势,进入本世纪以来,其已经基本取代搏动式人工心脏的地位。
2010年在美国上市的HeartMate Ⅱ,标志着旋转式(连续流)人工心脏作为一项革命性新技术被临床接受。旋转式人工心脏全面提升了系统的性能,包括临床使用寿命、不良事件发生率等关键指标,因而很快在市场上完全取代了搏动式血泵,相应地,LVAD使用范围拓宽到可供长期使用,即终极治疗。Dr. James W. Long表示,“HeartMate Ⅱ采用电子驱动系统,相比于HeartMate Ⅰ,HeartMate Ⅱ体积大幅减小,但在长期治疗中仍有较大概率出现血栓和出血等不良事件。
造成这一问题的原因在于,HeartMate Ⅱ实际上属于滑动轴承式LVAD,通过物理接触向转子传递支承力。由于轴承间隙中难免进入血液,同时轴承副因摩擦而发热,因而进入轴承间隙的血液成分因受到碾压或者经受高温而被损伤或变性,加上轴承附近的流场存在漩涡区等远离生理条件的流动形态,这些因素可导致轴承部位及其附近形成血栓。
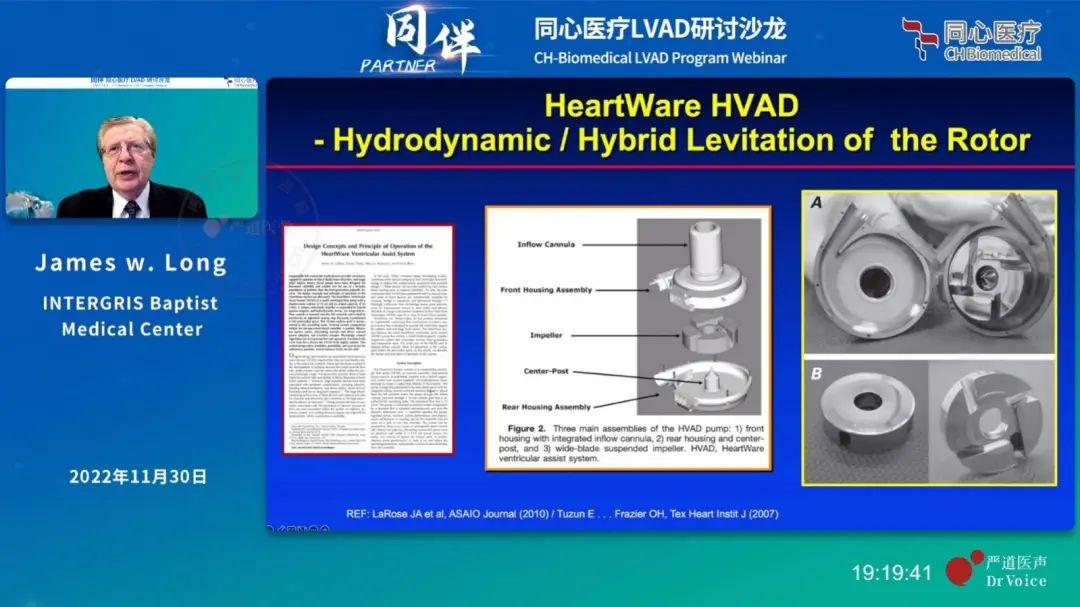
而同期出现的HeartWare生产的 HVAD则改进升级成为离心泵,采用流体动力悬浮技术(磁液悬浮)路线。通过血流压力的支撑,在轴承之间形成一层极薄的血液液膜。虽然实现了悬浮,避免了机械接触,但是如此薄的血液,却承受了远远高于生理值的剪应力,造成了血球破坏,血小板激活等血液损伤,引发大量的血栓和中风事件。
发展到这里,泵内血栓、中风、消化道出血等LVAD的血液相容性问题已经成为制约其适用范围,影响患者长期生活质量的主要因素。血液相容性主要用于评估医疗器械及其材料对血液或血液成分的影响,它与LVAD核心部件血泵所采用的技术路线及其结构和流道设计息息相关。
在科学家们的不断努力和技术的发展下,全磁悬浮技术路线的HeartMate 3在2014年横空出世。

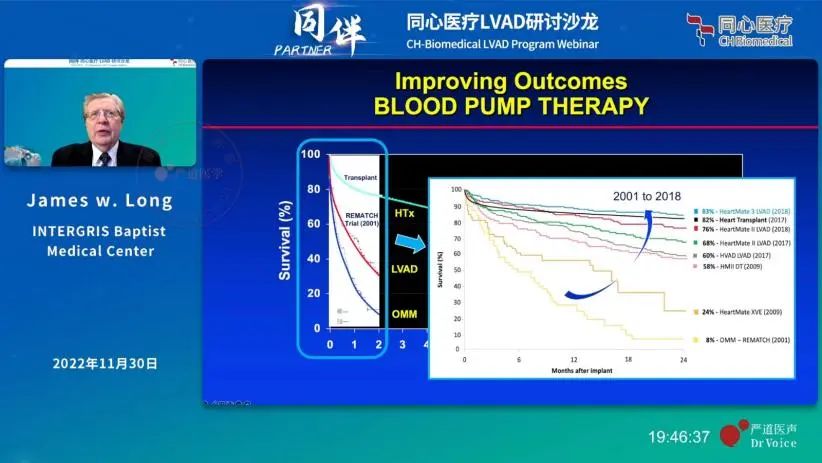
HeartMate 3引入了主动磁悬浮技术,通过受控电磁场让转子悬浮起来,并且在上下左右各维度上始终保持稳定,实现了真正意义上的全磁悬浮。无需血流压力支撑,悬浮间隙更大,让HeartMate 3的血液相容性跃上了一个新台阶。
从临床数据上来看,结果也是如此。HeartMate 3于2017、2018年在一个临床试验分别完成中短期、长期随访后,获得了美国FDA的中短期(short-term)、长期(long-term)用途的上市许可。其临床试验以HeartMate II为对照组,以2年复合生存率为临床终点(复合生存率:致残性中风、因装置本身引起的需要移除或置换的二次手术)。同时,HeartMate 3的血泵置换率降低到仅2.3%(几乎没有),对照组为11.3%。1此外,HeartMate 3在中风、主要出血、消化道出血等主要不良事件指标上也全面优于HeartMateⅡ。
生物标记物
HeartMate 3于2017年8月、2018年10月分别获得FDA的中短期、长期使用的适应症后,逐步占据了市场垄断地位,以此产品为代表的全磁悬浮技术成为美国乃至全球LVAD研发的领先技术。
只是,技术发展永无止境。全磁悬浮技术之后,LVAD还能在哪些方面得到优化?
Dr. James W. Long提出寻找并筛选生物标志物对衡量血液成分破坏的程度,预测临床不良事件的发生和后续继续优化LVAD有重要作用。
例如在LVAD发展早期大多通过红细胞来判断血液环境的好坏,而现在则出现了更多的生物标志物,大量临床试验数据证实,血小板、血管性血友病因子vWF(von Willebrand Factor)可以预测出血、血栓、脑卒中等临床不良事件。
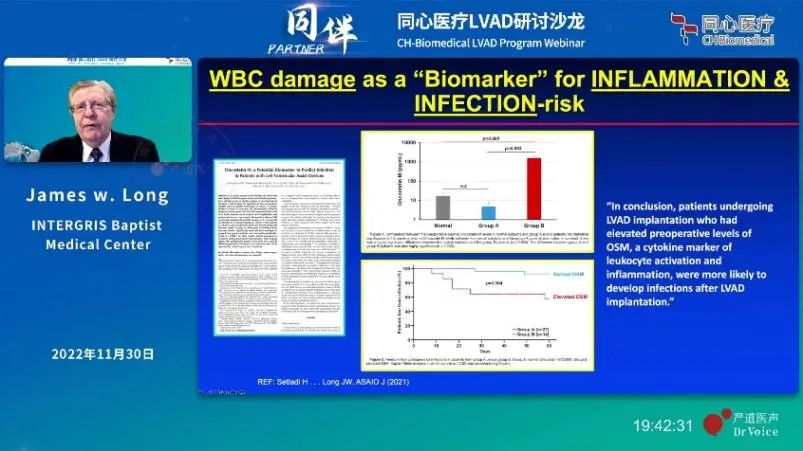
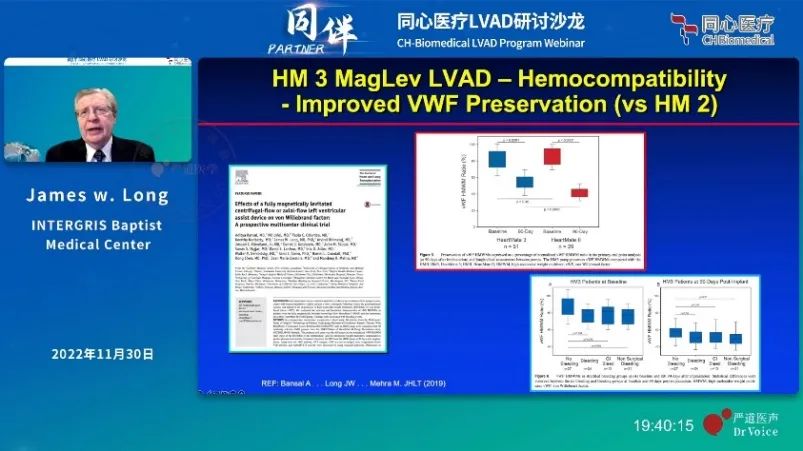
在高剪切应力的作用下,vWF构象发生变化,更容易暴露出ADAMTS13酶的酶切位点,从而变成更小的有活性的片段参与诱导血栓的形成。除此之外,osm(Oncostatin M)抑瘤素作为白细胞活化的标志物,可以评价炎症反应和感染的可能性。在临床试验中,与Heartmate Ⅱ相比,HeartMate 3可以更大程度上保护vWF,降低血栓的发生。
从历史中走来

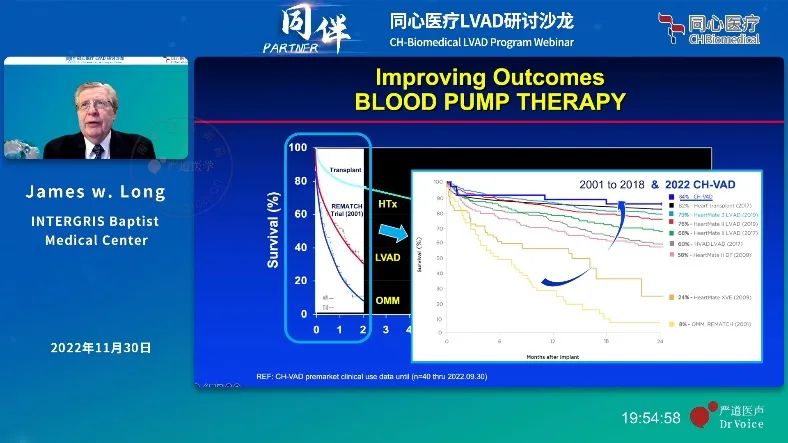
30年筚路蓝缕,研发者们一步步让LVAD实现了与心脏移植相媲美的治疗效果,全磁悬浮技术奠定了人工心脏血泵的新一代技术路线。
同心医疗在深厚的技术积淀下,突破层层研发壁垒,不断追求更优异的性能,打造出全球领先的全磁悬浮植入式心室辅助装置-慈孚®。不但在国内取得了优异的临床结果,更开始向世界贡献中国的力量。
问与答
本次活动得到了上海交通大学医学院附属瑞金医院的赵强教授、周密教授,中南大学湘雅二医院陈金兰教授、彭道泉教授、赵天力教授,浙江大学医学院附属第二医院董爱强教授,郑州市第七人民医院杨斌教授、郭长英教授、赵育洁教授,西安交通大学第一附属医院师桃教授、闫炀教授等多学科专家的支持。
Dr. James W. Long分享结束后,多位专家提出问题,引发大家广泛思考,热烈讨论,Dr. James W. Long也给出众多建设性意见。
赵强教授:怎样确定泵内血栓的形成是由于血液相容性导致的?
血液相容性是医学器械应用时必须要考虑的重要因素。众多实验室中的体外试验已证实,血液通过泵时受剪切力和应力的变化,血液中的凝血因子和出血相关因子会受到损伤或激活,一旦受到损伤或激活,则会出现系统性不良事件的发生,血液中的成分也会发生的理化变化。众所周知,心衰末期的患者发生脑卒中的风险非常大,但在近千例接受HeartMate 3 植入治疗的患者中仅有5-6%的概率发生脑卒中,发生泵中血栓的概率也很低。当然,在未来也会继续研究vWF等生物标志物对血液成分评估的作用,不断提高设备的血液相容性。
郭长英教授:怎样应对患者植入LVAD后的长期抗凝过程?
相比于心脏移植,接受LVAD植入可以不用进行抗排斥治疗,但泵内血栓的形成仍是一大缺点。临床数据显示,Heartmate Ⅱ在长期植入后因泵内血栓有20-30%的概率需要二次换泵,HeartWare HVAD血栓发生率有所降低,但仍比HeartMate 3高,HeartMate 3泵内血栓发生几率很低,接近0,几乎解决了因泵内血栓进行二次换泵的问题。但目前还没有临床数据单独对抗凝治疗进行对照研究,仍建议采用阿司匹林抗栓,华法林抗凝。也有相关学者提出全磁悬浮泵可以用一种抗凝药物,甚至不用,期待有更多的临床数据来指导临床治疗。
师桃教授:LVAD和心脏移植两种方式的的选择?肺动脉高压对植入的影响?
HeartMate 3在生存期的延长效果上可以与心脏移植相媲美。究竟是选择LVAD还是心脏移植,应取决于多学科会诊的共同决策,充分考量前期的医学治疗决策,选择更适宜的方式。有肺动脉高压的患者往往不适合接受心脏移植,精确评估左心室充盈压力等相关指标,选择LVAD植入治疗可以带来一定的生存获益。
赵育洁教授:怎样看待心律失常患者植入LVAD后对心率的管理?
首先应明确心律失常原因,进行EP检查等,很多房颤患者不适合LVAD植入,植入后心率问题也不会有明显好转,此类患者应关注血栓发生的风险,持续抗凝治疗。
同心引领
历史是过去的现实,现实是未来的历史。
我们每一次向历史深处的回眸,都是一次精神的洗礼、一次思想的升华、也是一次行动的感召。
同心医疗临床运营副总裁Karl Nelson先生会后总结中则表示:
耕耘多年,同心医疗不断对产品优化升级,提升血泵的血液相容性及经皮电缆的防感染性能,降低手术侵犯性,提升产品的可靠性,让患者活动自由度更高。在当前LVAD行业开始进入全磁悬浮时代的背景下,慈孚®VAD已展现出良好的临床应用前景,相信在中美等众多专家的参与支持下,同心医疗会以技术实力引领国际人工心脏领域实现跨越式发展。
参考文献:
1.M Mehra, N Uriel, Y Naka, et al. A Fully Magnetically Levitated Left Ventricular Assist Device — Final Report, N Engl J Med,380: 1618-27, 2019.
2.J Teuteberg, J Cleveland, J Cowger, et al. The Society of Thoracic Surgeons Intermacs 2019 Annual Report: The Changing Landscape of Devices and Indications, Ann Thorac Surg, 109: 649-60, 2020.
3.https://www.medtechdive.com/news/abbott-Heartmate-3-survival-rate/630765/
4.I.M. Hamour, A. Khaghani, P.K. Kanagala, A.G. Mitchell, N.R. Banner. Current outcome of heart transplantation: a 10-year single centre perspective and review, An International Journal of Medicine, Volume 104, Issue 4, April 2011, Pages 335–343.