西京结构文献谈|3D生物打印主动脉瓣中细胞内蛋白质组学和细胞外囊泡组学作为疾病还原的度量标准
2025-02-14 19:14


2025年2月(总第14期)
作者:毛予 刘洋 杨剑
////////////////////////////////////////
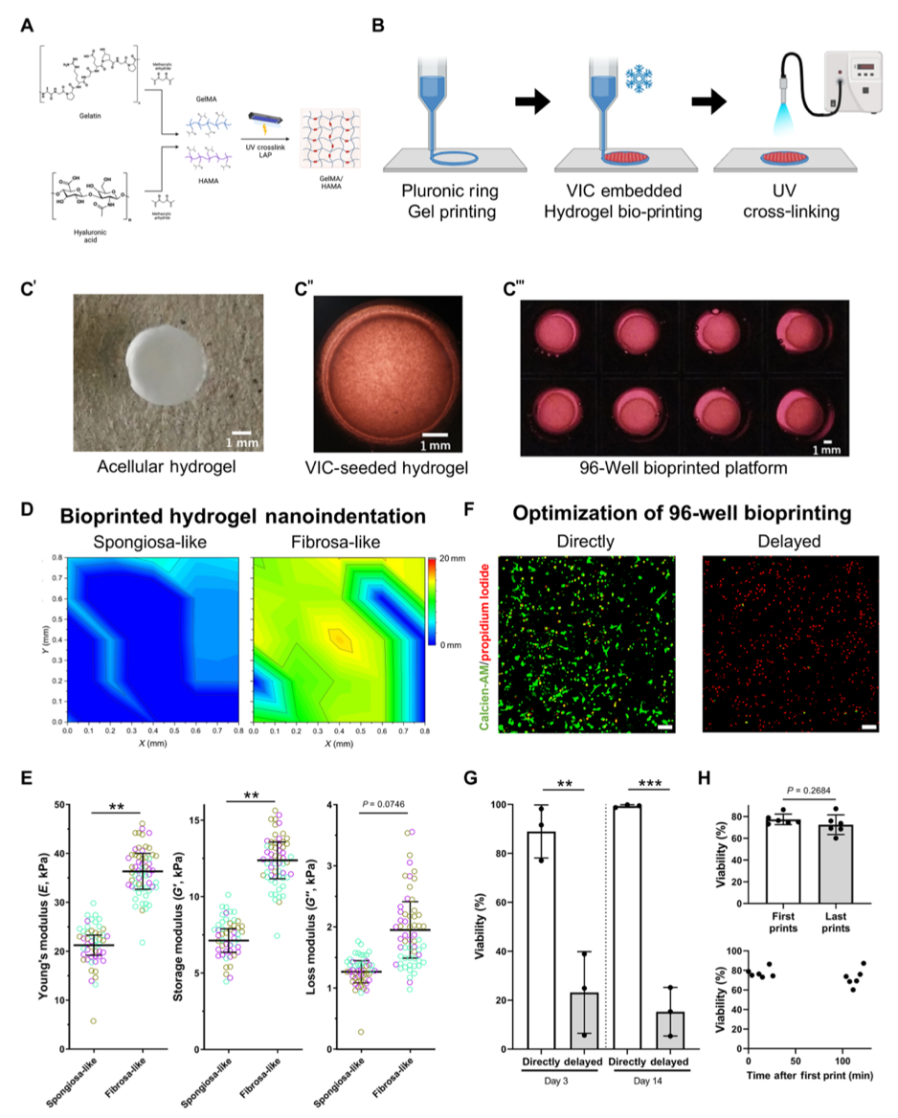
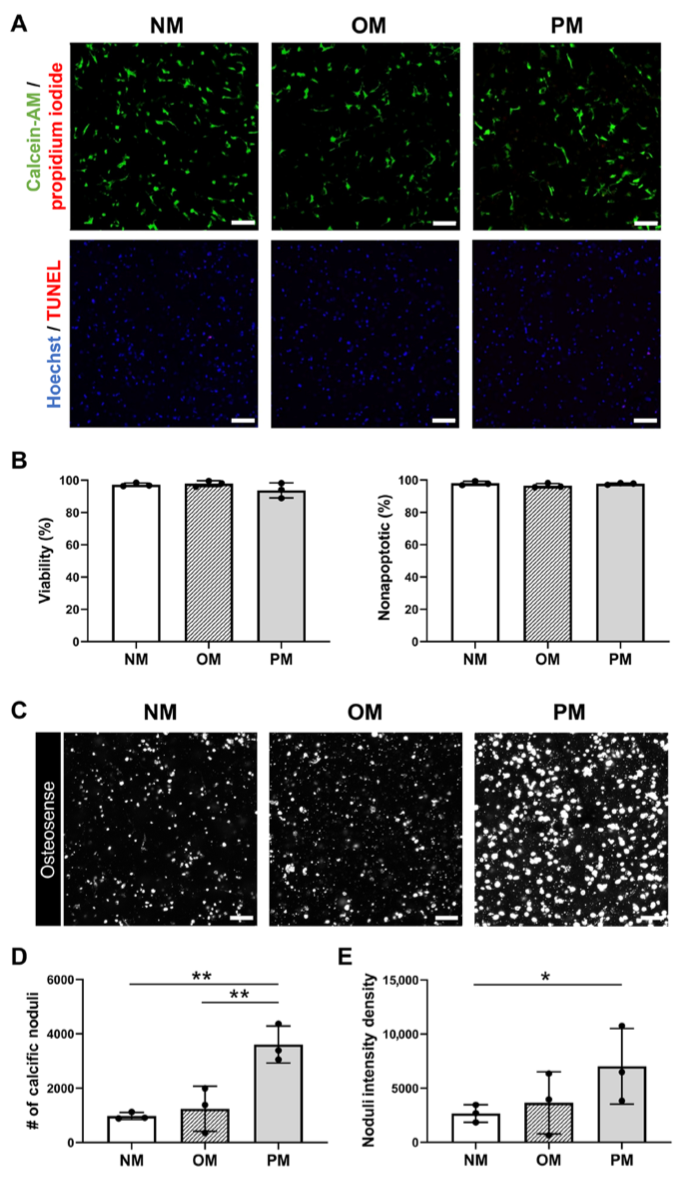
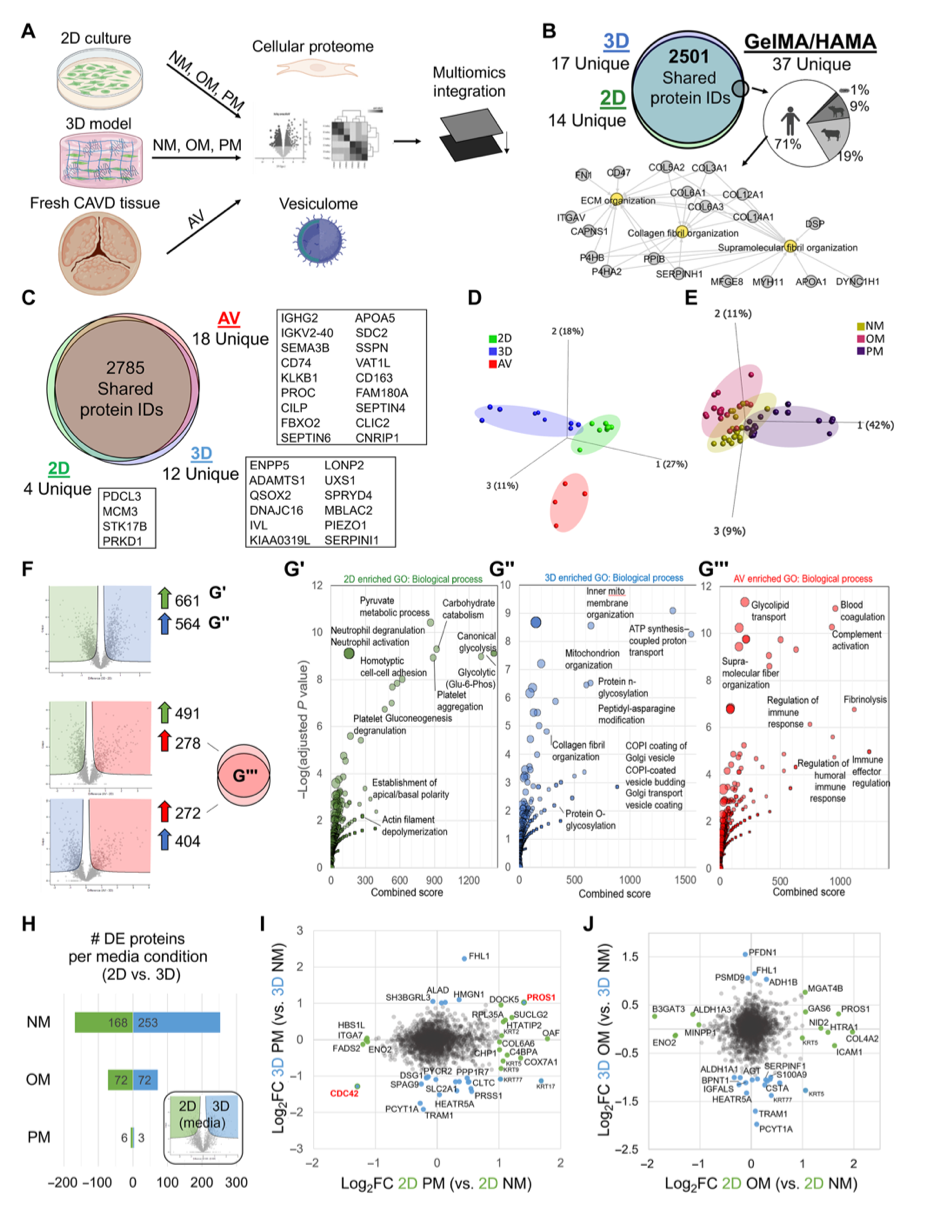
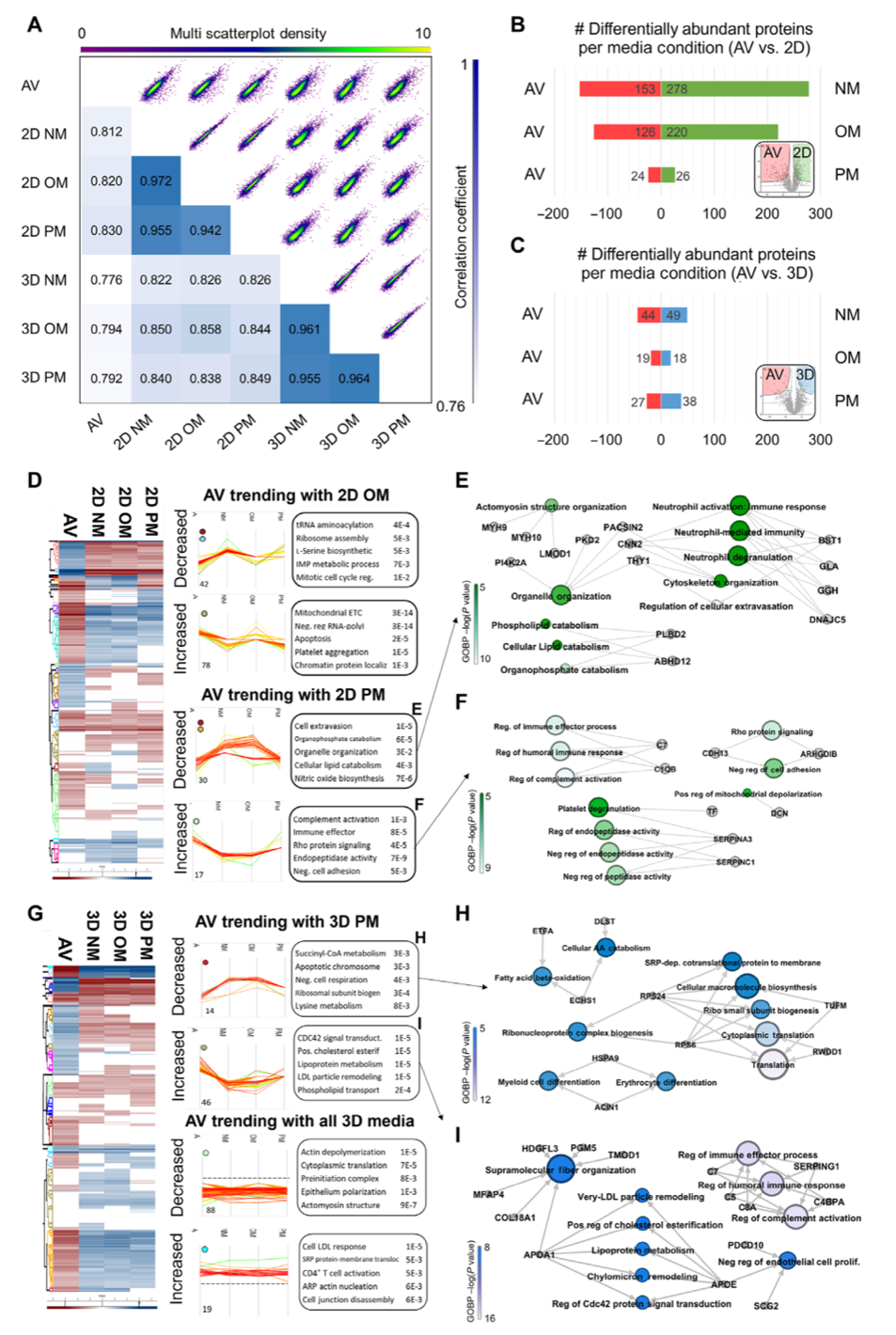
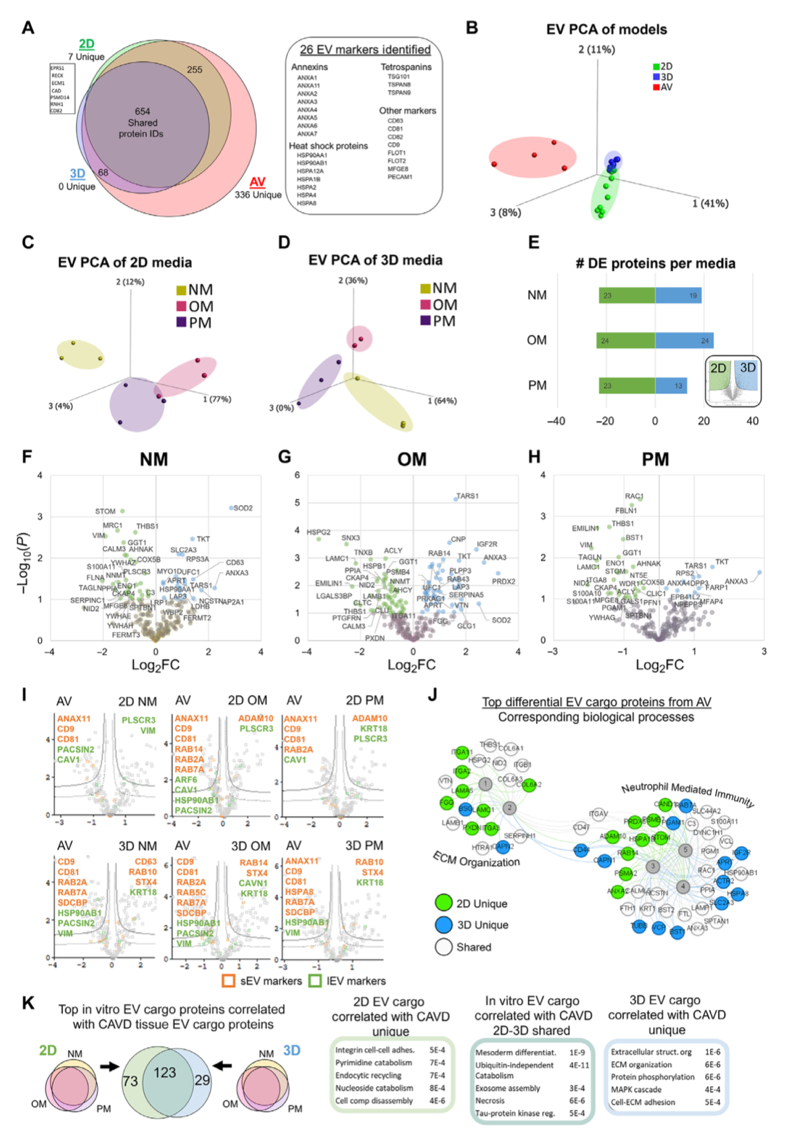
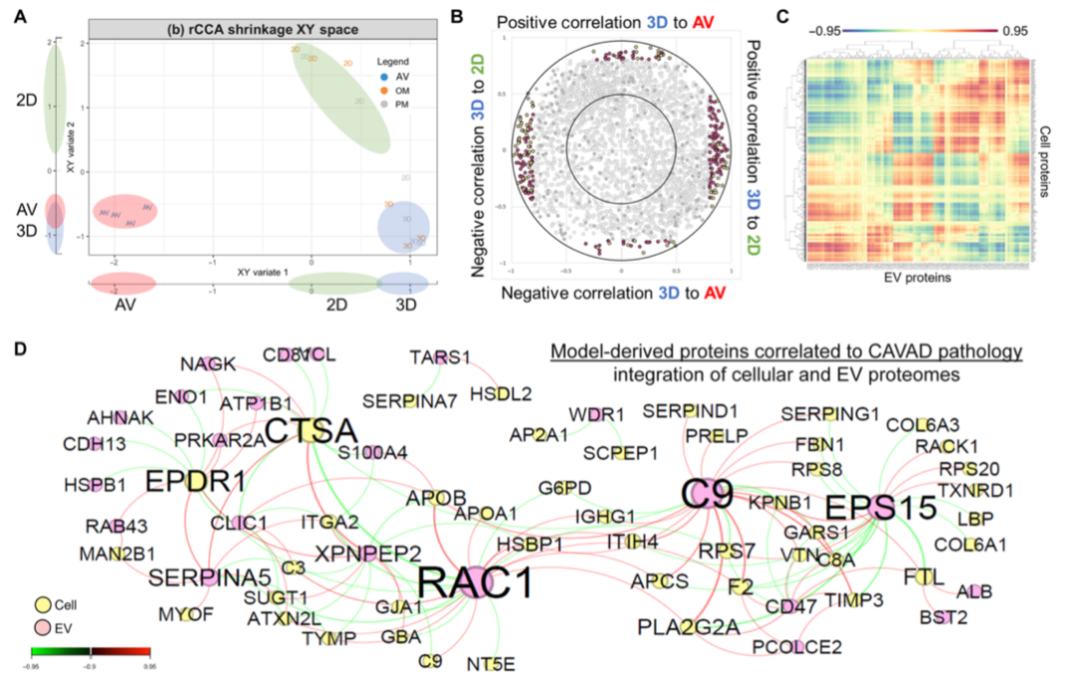
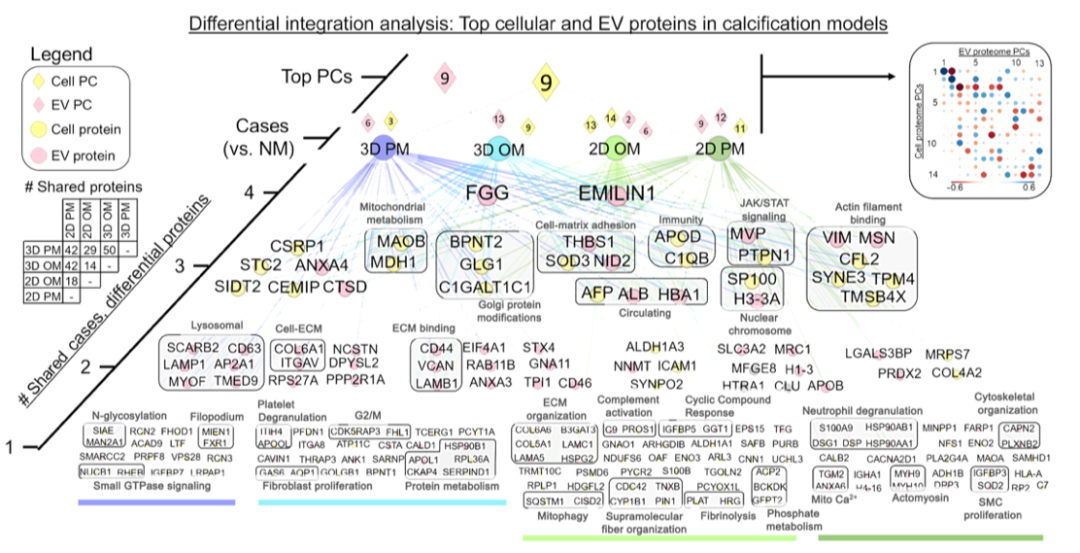
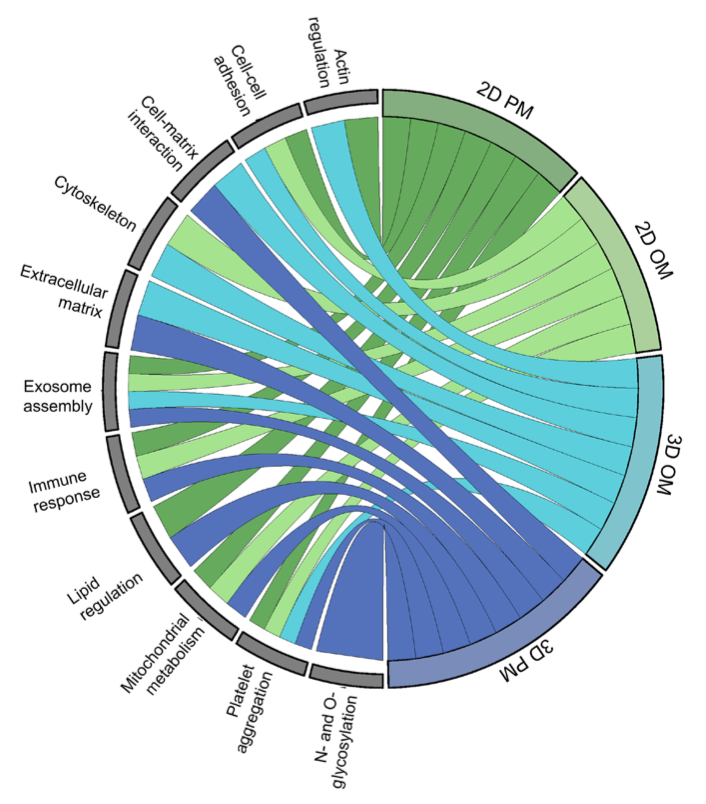
引言:来自美国哈佛大学医学院的Elena Aikawa团队建立了一种基于生物材料的CAVD模型,模拟了人类易患纤维层的生物力学特性,并将其3D生物打印到96孔板中。通过液相色谱串联质谱分析细胞蛋白质组和囊泡组,比较了3D生物打印模型与传统的2D单细胞培养模型与人类CAVD组织之间的差异。3D生物打印模型高度重现了CAVD细胞蛋白质组(与2D蛋白质的70%相比,达到94%)。将细胞和囊泡数据集整合起来,识别出与AV钙化普遍相关的已知和未知蛋白质。哈佛大学医学院的研究团队研究探讨了2D和3D生物工程系统如何重现人类疾病的独特方面,将多组学作为一种评估高通量生物工程模型系统的技术,并为未来的药物发现提供了潜力。相关工作以题为“Intracellular proteomics and extracellular vesiculomics as a metric of disease recapitulation in 3D-bioprinted aortic valve arrays”的文章发表在2024年2月28日《Science Advances》。

结论与下步展望

文章来源
https://www.science.org/doi/10.1126/sciadv.adj9793