随着认知的深入,心肌病的定义与分类正经历快速的进展与演变,准确地进行心肌病的诊断与鉴别诊断成为临床关注热点及挑战。与实验室、影像学及遗传学等无创检查一样,心内膜心肌活检(EMB)和病理检查作为重要的有创检查依据,在明确诊断、指导治疗、评估预后中发挥着不可替代的作用。近期《Biology》杂志发表了一篇“Storytelling of Myocardial Biopsy”,讲述了心脏活检的发展历程。

1.心脏活检的历史
活检意味着从活体患者身上采集一块组织或整个器官。
就心脏而言,经胸壁针刺活检最初由Casten和Marsh于1953年完成,Kent等人于1956年完成。
自1954年以来,体外循环下的心脏直视手术使得心脏活检成为可能。
经静脉心内膜心肌活检(EMB)通过导管末端的活检钳完成,最初由Sakakibara和Konno于1963年首次完成(图1),Richardson于1974年完成(图2)。
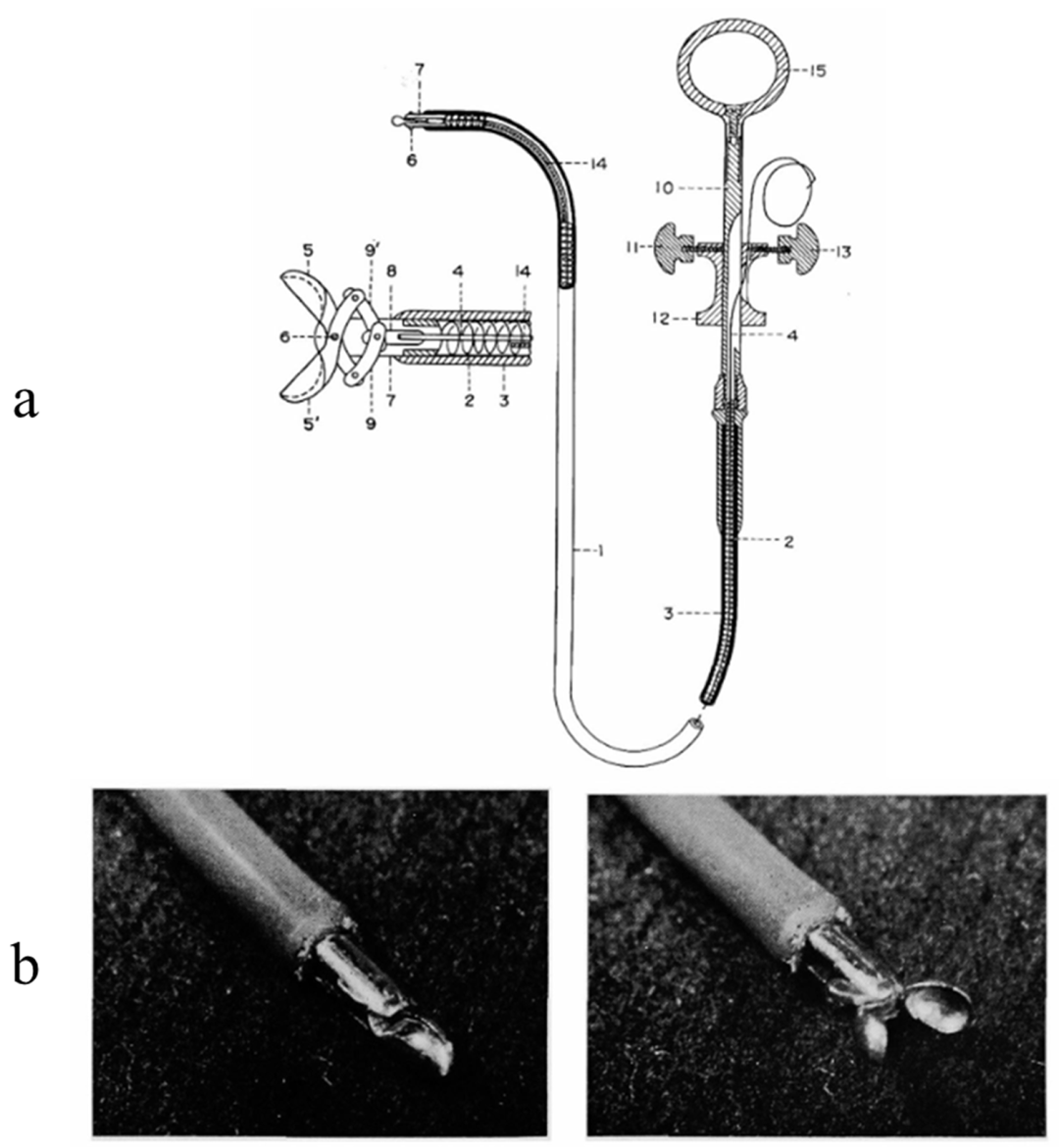
图1.Konno用于心内膜心肌活检的器械(a)。Sakakibara和Konno于1963年在日本完成的经静脉心内膜心肌活检(EMB)技术(b),导管末端带有活检钳。

图2.通过经股静脉途径进行心内膜心肌活检(EMB)(a)和心内膜心肌组织(b)。
2. 心脏移植和心肌病
随着心脏移植的开展,Christiaan Barnard于1968年,Shumway于1969年进行了“整个心脏切除术”并植入了供体心脏。外科医生将活体人类的整个心脏从手术室送到病理学家那里。这是一个发现和研究新疾病的机会。
严重的扩张型心肌病(DCM)是心脏移植最常见的指征,提供了深入研究所谓的“cor bovinum”的机会(图3)。

图3.意大利首例心脏移植中的扩张的心脏。(a)心脏的大体视图;(b)使用苏木精-伊红染色的组织学显示肌原纤维溶解。
特发性限制性心肌病(RCM)代表了一组需要移植的小心脏疾病(图4),因为心室在舒张期无法扩张,导致严重的充血性心力衰竭。由于组织学显示心肌纤维错位,遗传背景显示与肥厚型心肌病(HCM)一样累及肌节蛋白,这种状况被称为“无肥厚的HCM”。

图4.限制性心肌病。(a)扩张型与限制型心肌病的比较。(b)限制性心肌病组织学显示心肌纤维错位。使用Azan Mallory染色。
同样在心脏移植过程中,还发现了一种令人惊叹的心肌病,名为“左心室致密化不全”,表现为心肌收缩力差,由粗大的肌小梁和肌小梁间深陷隐窝组成,心内膜几乎延伸到心外膜(图5)。二维超声观察到的肌小梁可能被误认为是附壁血栓。

图5.(a)左心室致密化不全;(b)粗大的肌小梁,可能被超声误认为是血栓。
血色素沉着症是一种继发性心肌病,心肌呈棕色(图6),因为心肌储存了血红蛋白铁。多次输血可能是其原因。

图6.血色素沉着症的心脏标本。(a)大体检查显示棕色心肌。(b)心肌细胞内铁颗粒沉积。(c,d)心内膜心肌活检显示心肌细胞内铁颗粒沉积。
此外,原发性心脏肿瘤也可以在心脏移植过程中被诊断出来。
心脏纤维瘤通常位于室间隔内,类似于肥厚型心肌病的不对称性间隔肥厚,可能在心脏移植前被超声错误诊断(图7)。

图7.巨大的心脏纤维瘤。(a)大体视图显示室间隔受累,类似于肥厚型心肌病。(b)在组织学上,该占位由胶原蛋白组成。使用Azan Mallory染色。
3. 致心律失常性心肌病
医学史上的另一个伟大发现是致心律失常性心肌病(ACM),由Sergio Dalla Volta于1961年发现。在血管造影观察到,右心室扩大(图8),以至于被称为“右心室耳状化”。后来,随着心脏移植的出现,患者于1996年成功接受了手术(原文为1989年,经查阅文献为1996年,Marrone D., Zampieri F., Basso C., Zanatta A., Thiene G. History of the discovery of Arrhythmogenic Cardiomyopathy. Eur. Heart J. 2019;40:1100–1104. doi: 10.1093/eurheartj/ehz145)。受体心脏显示右心室腔整体扩张,壁薄而透明,呈纤维脂肪变性。奇怪的是,在1961年,“耳状化”右心室被认为是心肌梗死的后遗症。当时,冠状动脉造影还不存在,冠状动脉只能在尸检期间观察。
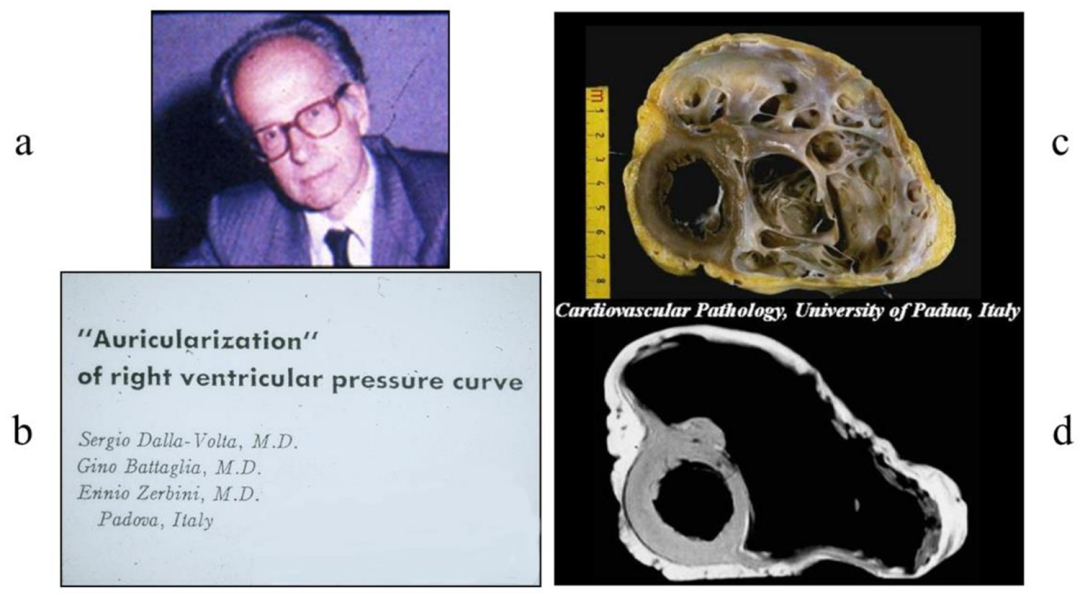
图8.Sergio Dalla Volta(a)于1961年发表的女性ACM患者的图像(b),显示右心室腔整体扩张和变薄的游离壁(c,d)。1996年,她因充血性心力衰竭成功接受了心脏移植。
4. 心导管术的历史
EMB历史上的一个里程碑可以追溯到1929年,当时德国泌尿科医生Werner Forssmann发明了心导管术(图9),成功地通过左桡静脉插入导尿管进入自己的右心室。

图9.与骨骼肌活检不同,心肌活检只能在尸检时进行。随着1929年德国泌尿科医生Werner Forssmann(1904-1979)(a)发明了心导管术,可以在体内安全地到达右心室(b)。
EMB导管到达右心室间隔面的肌小梁处,在此处进行EMB(图10)。

图10.带有活检钳的导管在右心室(a)和间隔肌小梁(b)处,进行心内膜心肌活检。
5. 显微镜的发明
1665年,Robert Hooke发明了显微镜,用于观察细胞。(图11)

图11.Robert Hooke(1635-1703)于1665年发明了显微镜,用于观察细胞的显微图形。
6. 通过心内膜心肌活检监测心脏移植排斥反应
为了监测心脏排斥反应(图12),1970年,Margaret Billingham发明了一种通过右颈静脉的新入路(图13),这使得在心脏移植后每周进行EMB变得更容易和更快捷。

图12.心脏排斥反应。(a)血液循环中的T淋巴细胞。(b)心肌被T淋巴细胞浸润。
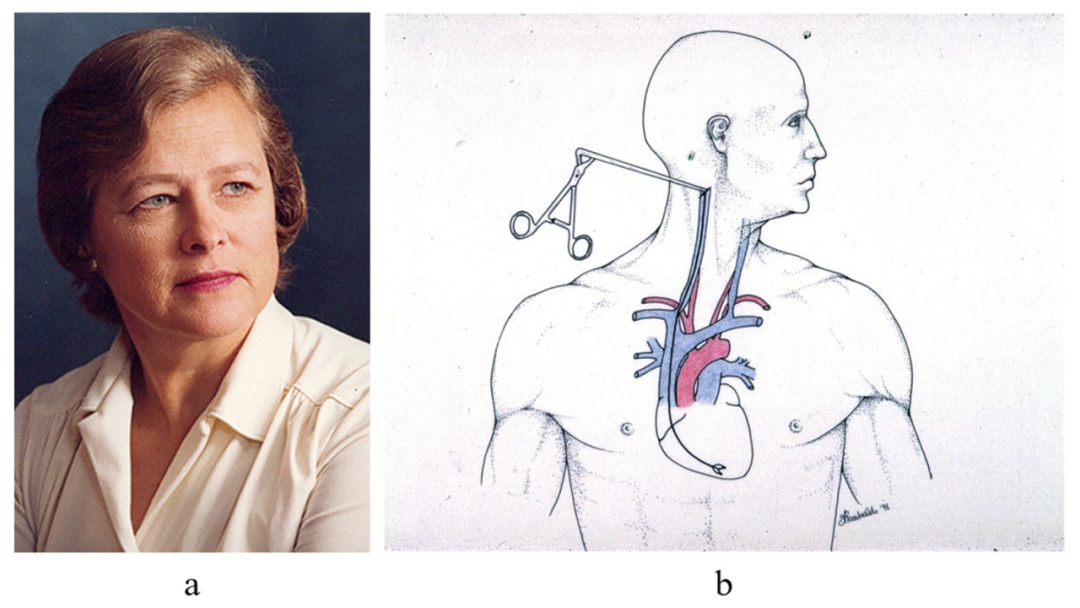
图13.1970年,Margaret Billingham(a)(1930-2009)发明了通过颈静脉进行EMB以监测心脏排斥反应;(b)经颈静脉途径。
7. 心内膜心肌活检的临床指征
Ferrans 和 Roberts 等权威病理学家在早年对EMB的效用提出了质疑。

表1.质疑EMB的效用。
活检段是否代表整个心脏的状态?
心内膜心肌活检是否足够有用,以平衡风险?
心内膜心肌活检是否在临床决策中发挥作用?
EMB在心脏肿瘤的诊断中被证明是非常有帮助的。通过二维超声在右房室沟发现的占位接受了EMB和特定的免疫组化,诊断为血管肉瘤(图14)。

图14.右房室沟占位的EMB(a)。免疫组化显示该占位为血管肉瘤(b-d)。
根据我们的经验,通过EMB免疫组化确诊的心脏恶性肿瘤的其他例子包括T细胞心房淋巴瘤(图15)和心脏纤维肉瘤(图16)。

图15.通过EMB免疫组化诊断的心房淋巴瘤。

图16.通过EMB免疫组化诊断的心脏纤维肉瘤。
EMB在非恶性占位的鉴别诊断中也非常有用,如嗜酸性粒细胞增多性心内膜炎(Loeffler心内膜炎),也称为闭塞性限制性心肌病(图17)。

图17.Loeffler心内膜炎的EMB(a-c)显示嗜酸性粒细胞浸润(d)。
表2显示了EMB的指征。

表2.EMB的指征。
心脏移植后监测
非缺血性心力衰竭
心律失常
冠状动脉正常的胸痛
心脏占位
在心肌炎方面,EMB在确定组织类型(淋巴细胞性、中性粒细胞性、嗜酸性粒细胞性、非干酪性肉芽肿性和巨细胞性)方面发挥关键作用(图18),这是治疗策略的基本信息来源。

图18.心肌炎的多种组织类型:淋巴细胞性、中性粒细胞性、嗜酸性粒细胞性和巨细胞性。
8. 聚合酶链反应的发明:分子病理学
淋巴细胞性心肌炎通常是病毒性来源的。在1983年Kary Mullis发明聚合酶链反应(PCR)之后(图19),现在可以通过EMB确定病毒类型。
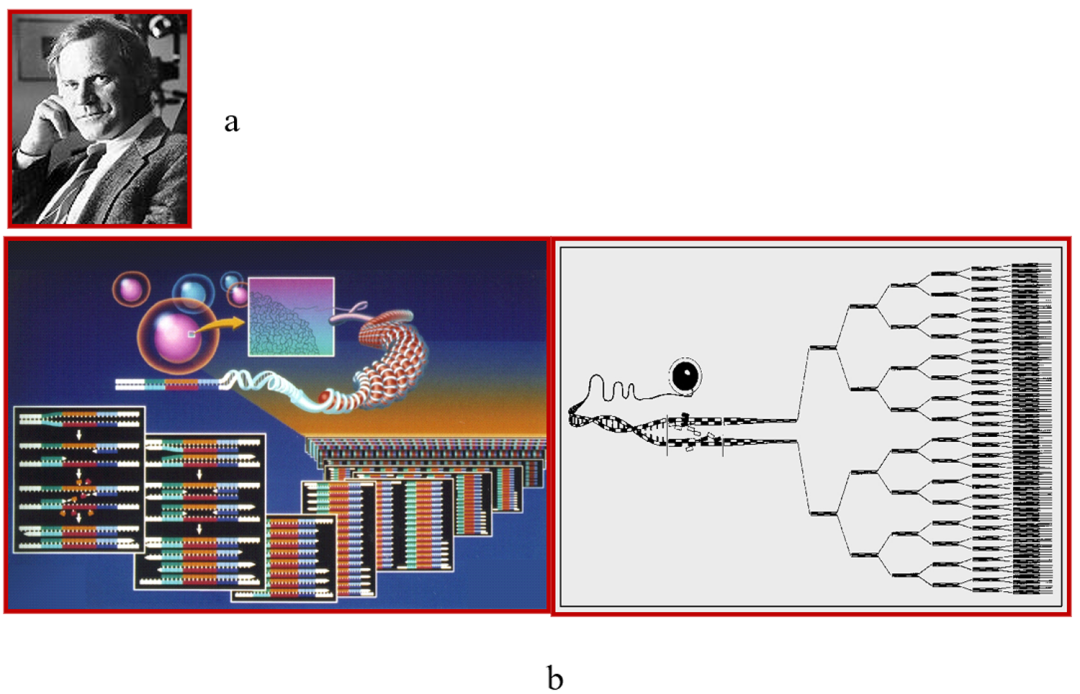
图19.1983年,Kary Mullis(a)发明了聚合酶链反应(PCR)(b)。
危及生命的病毒性心肌炎不仅影响成人,还影响儿童和婴儿(图20)。

图20.通过病毒PCR证实的儿童(a)和成人(b)心肌炎。
目前,通过组织学和光学显微镜(染色组织切片、组织化学和免疫组化)以及电子显微镜、分子生物学(原位杂交、PCR和基因测序)可以准确解释EMB。分子水平分析是诊断金标准的一部分(表3)。

表3.炎症性心肌病的心内膜心肌活检。

通过电生理标测进行临床研究对于检测心肌疾病(如ACM)中的瘢痕以及确定在哪里进行EMB可能具有战略意义(图21)。
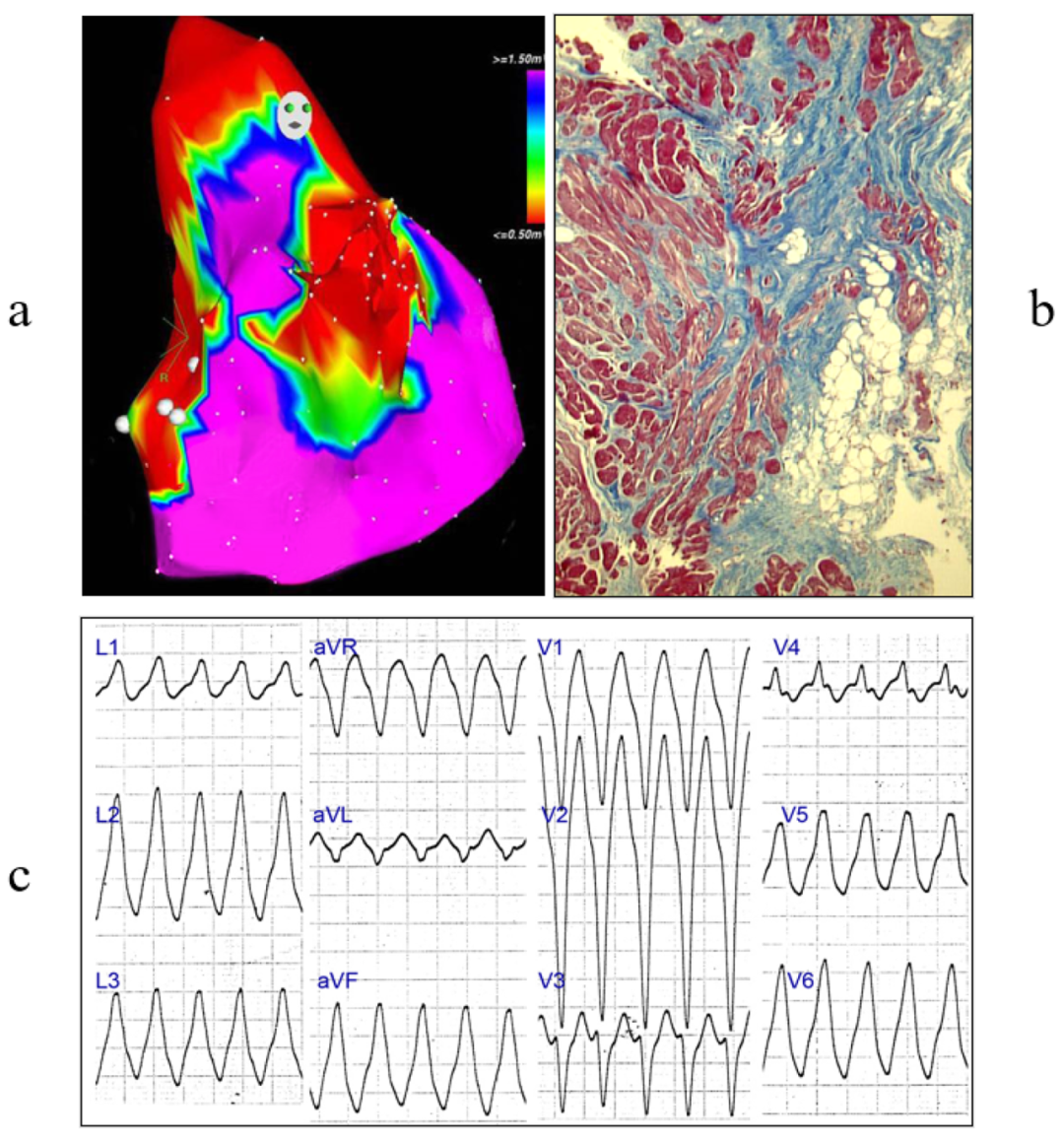
图21.ACM中的EMB。(a)电瘢痕的电生理标测;(b)纤维脂肪变性(Azan Mallory染色);(c)室性心动过速。
9. 通过心内膜心肌活检诊断ACM和浸润性疾病如淀粉样变性
通过对ACM的尸检心脏标本进行体外活检(图22),发现残余心肌<59%具有诊断意义,特异性为90%,敏感性为80%。(图23)
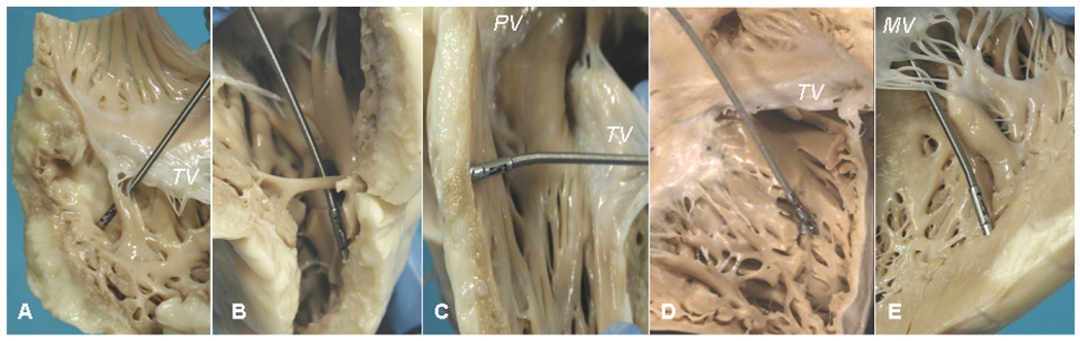
图22.ACM的EMB和尸检标本活检。右心室显示游离壁的纤维脂肪变性(A,B)。带有活检钳的导管模拟心内膜心肌活检(C)。右心室和其他带有活检钳的导管的其他图片(D,E)。
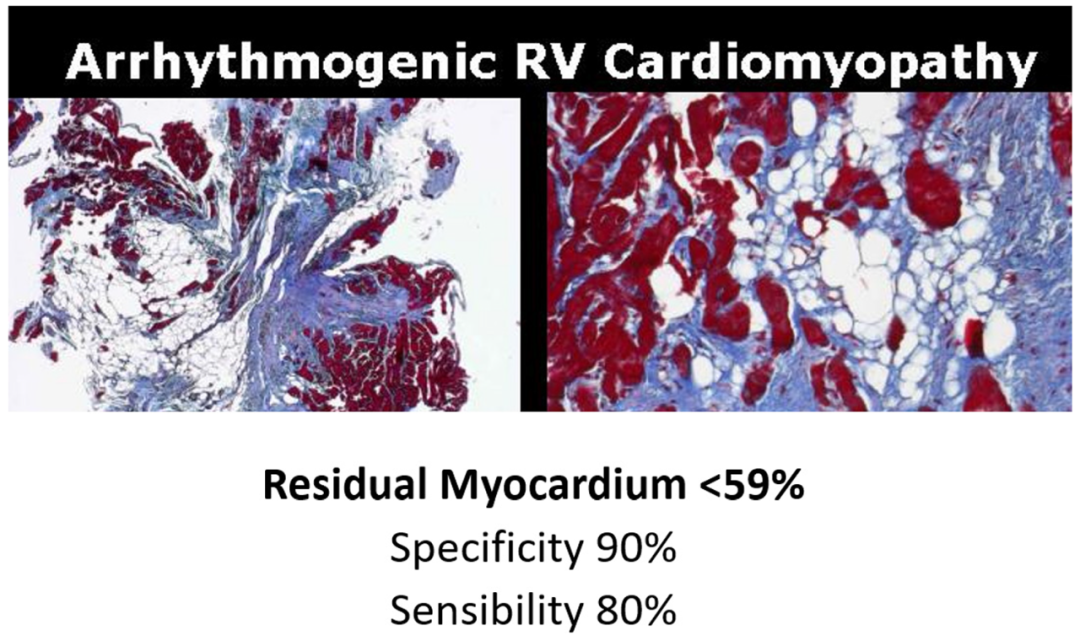
图23.残余心肌(<59%)在ACM诊断中的特异性(90%)和敏感性(80%)。
通过EMB和使用刚果红和Tioflavine染色可以轻松检测到淀粉样变性等浸润性疾病(图24)。

图24.使用特定染色,通过EMB诊断心肌间质淀粉样变性的浸润性疾病。
10. EMB和电子显微镜
电子显微镜对于Fabry病(溶酶体贮积病)的诊断特别有用(图25),电子显微镜用于检测细胞凋亡作为心肌细胞死亡模式(图26),以及ACM中桥粒的破坏(图27)。

图25.Fabry病:一种继发性肥厚型心肌病,通过电子显微镜诊断。

图26.ACM中心肌凋亡的电子显微镜。原始放大倍数,×14,500。

图27.ACM的电子显微镜。透射电子显微镜显示与正常桥粒(a)相比,桥粒复合体中断(b)。原始放大倍数,(a)×30,000;(b)×50,000。方框包含正常桥粒(a),而箭头指示ACM中的中断桥粒(b)。
11. 心内膜心肌活检和心肌炎:体外膜肺氧合的发明及其有效性
就心肌炎而言,“Dallas标准”提出,要达到诊断目的,心肌细胞坏死是与炎症浸润相关的“必要条件”(图28)。在没有心肌坏死的情况下观察到心肌炎症和间质水肿(图29),体外膜肺氧合(ECMO)由Robert Bartlett(1939-)发明(图30),暴发性心肌炎表现为突然发作的严重泵衰竭,由于可逆性心肌损伤而最终自行恢复。ECMO可以暂时提供心肌收缩支持,直到自发恢复。有了ECMO,暴发性心肌炎的存活率改善(图31)。

图28.Dallas标准。1985年,基于炎症浸润与心肌坏死相关的显微镜观察,心血管病理学会在Dallas提出了活动性心肌炎的诊断组织学标准。(a)活动性心肌炎。炎症细胞浸润伴有心肌细胞坏死的证据。(b)交界性心肌炎。炎症细胞浸润,没有心肌损伤的证据。使用苏木精-伊红染色。

图29.淋巴细胞性心肌炎,显示炎症浸润和间质水肿,没有心肌细胞坏死。

图30.Robert Bartlett(1939-)(b)发明了ECMO(a)。

图31.在(儿童和成人)暴发性心肌炎中使用ECMO时实现的心肌恢复和存活率。
左心室辅助装置(LVAD)是另一种机械支持疗法,也作为心肌标本获取的来源,可用于组织学和分子分析(活检)。
12. 结论
EMB是诊断心肌炎、心脏移植后排斥反应和浸润性/贮积性疾病的金标准。EMB得出的组织类型可用于指导药物治疗策略。分子生物学技术应作为有用补充常规进行。取样至关重要(表4)。炎症性心肌病诊断的金标准是组织学、免疫组化和分子分析的结合(表3)。EMB应在完整的病理检查“武器库”均可用的情况下进行。

表4.EMB取样。
至少4-5个样本,大小1-1.5mm
取样来自不同的位置
3-4个样本用于组织学和免疫组化(10%缓冲福尔马林)
连续组织学切片
在选定情况下,1个样本用于电子显微镜(固定在2%戊二醛)
1-2个样本用于分子活检(冷冻-80°)