

使用导管消融进行肺静脉隔离是治疗症状性阵发性心房颤动的有效方法,在维持窦性心律和减轻症状方面优于抗心律失常药物【1-3】。射频消融或冷冻球囊消融等热消融技术一直是肺静脉隔离的主要手段,两种技术的成功率相近【4-6】。然而,射频和冷冻消融缺乏组织特异性,会增加邻近结构损伤的并发症的风险,比如肺静脉狭窄、膈神经麻痹和心房食管瘘【7,8】。
脉冲消融(PFA)是一种对心肌组织具有高度选择性的非热消融方法【9】。临床前研究【10,11】和大规模观察性研究【12】已证实其安全性。ADVENT试验【13】表明,与射频和冷冻相比,房性心律失常复发率相似。然而ADVENT研究缺乏对患者进行持续的心律监测,限制了检测房性心律失常复发和房颤负荷的敏感性。
SINGLE SHOT CHAMPION研究
通过植入式心脏监测器评估房性心律失常复发情况,严格比较PFA与冷冻消融在症状性阵发性房颤患者中的疗效。
在降低房性心律失常复发率方面,PFA优于冷冻消融。
PFA手术时间对比冷冻消融手术时间缩短25%。
1.研究背景
SINGLE SHOT CHAMPION是一项由研究者发起的随机对照研究。该试验由Inselspital (University Hospital Bern) 和 University Hospital Basel资助。患者以1:1的比例随机分配接受脉冲消融(Farapulse,波士顿科学公司)或冷冻球囊消融(Arctic Front,美敦力)进行肺静脉隔离。首次手术后3个月内(空白期)不允许重复消融手术。所有患者均植入了植入式心脏监测器(Reveal LinQ,美敦力),用于连续心律监测。房性心律失常复发被定义为至少30秒连续房性心律失常发作。抗心律失常药物允许在3个月空白期内使用,但此后必须停止使用。随访包括每天自动传输植入式心脏监测器的数据以及在术后3、6和12个月时的回院随访。
2.终点信息
主要终点:消融术后第91天至365天内首次出现持续时间≥30秒的房性心律失常(包括房颤、房扑或房速)复发。
安全性终点:由以下并发症组成的复合终点:需行心包穿刺术的心脏压塞、持续超过24小时的膈神经麻痹、需干预的严重血管并发症、卒中或短暂性脑缺血发作、心房食管瘘,以及术后30天内死亡。
次要心律失常终点:术后第1-90天及第1-365天内首次房性心律失常复发;房性心律失常负荷(定义为患者在第1-90天及第91-365天内处于房性心律失常状态的时长百分比);在术后3个月和12个月进行健康相关生活质量(采用EQ-5D-5L评估,评分范围0-100分,分值越高表示健康状况越好)评估
次要临床终点(术后1年):包括死亡、卒中或短暂性脑缺血发作、因房性心律失常复发导致的非计划住院或急诊就诊、针对复发的心律失常进行的心律转复、重复消融手术,以及抗心律失常药物的重新启用。
3.基线信息
从2022年9月20日至2023年11月16日,共有210名患者被随机分配接受PFA(105名患者)或冷冻球囊消融(105名患者)。两组患者基线情况基本平衡,患者的平均年龄为64岁,女性占28%(表1)。

表1:基线信息
4.治疗特征
各中心对PFA和冷冻球囊消融的经验见表2,在研究开始前,PFA在欧洲CE获批仅有半年时间。所有患者均按分配进行了肺静脉隔离。PFA组的平均手术时间为55分钟,冷冻球囊消融组为73分钟(差异为-18.3分钟;95% CI -25.1至-11.6);两组的平均透视时间分别为14.6分钟和15.1分钟。
三尖瓣峡部射频消融在PFA组的14名患者(13.3%)和冷冻球囊消融组的12名患者(11.4%)中进行。PFA组和冷冻球囊消融组的高敏肌钙蛋白平均(±SD)水平分别为1920±954 ng/L和1114±419 ng/L(差异为823 ng/L;95% CI 612至1034)。PFA组中有7名患者(6.7%)和冷冻球囊消融组中有21名患者(20.0%)检测到左肺静脉共干。
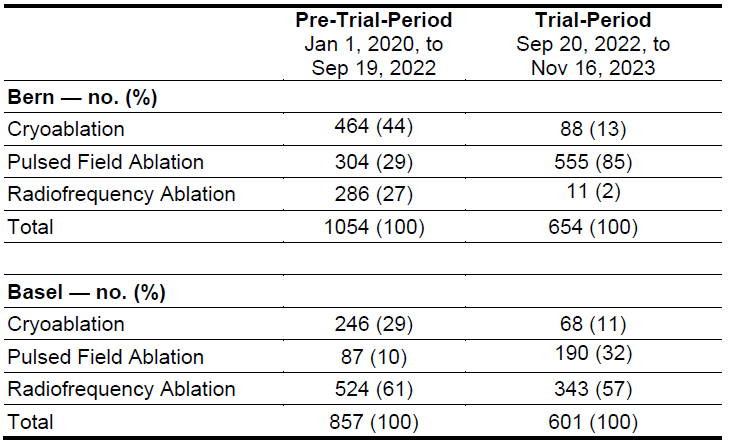
表2:研究中心消融经验
5.终点结果
主要终点:PFA组39例患者和冷冻球囊消融组53例患者达到主要终点(Kaplan-Meier累积发生率分别为37.1%和50.7%,差异为-13.6%;95%CI -26.9至-0.3;非劣效性检验P<0.001,优效性检验P=0.046)(图1和表3)。

图1:第91天至第365天,无房性心律失常复发

表3:主要和次要终点
空白期(第1天至第90天)内,PFA组与冷冻球囊消融组的房性心律失常复发率差异为-20.0%(95% CI -33.2至-6.8);第1天至第365天,差异为-18.2%(95% CI -31.5至-4.9)(图2和表3)。

图2:第1天至第365天,无房性心律失常复发
根据zero-inflated beta regression估计,第91天至第365天,PFA组平均心房心律失常负荷为1.4%,冷冻球囊消融组为1.9%(差异为-0.5%; 95%CI -1.4至0.4)。第1天至第90天,差异为-2.4%(95% CI -4.5至-0.3),第1天至第365天,差异为-0.9%(95% CI -1.8至0.1)(表3)。
安全性终点:30天内安全性复合终点(包括需心包穿刺的心脏压塞、持续>24小时的膈神经麻痹、需要干预的严重血管并发症、卒中/短暂性脑缺血发作、心房食管瘘或死亡)在PFA组发生1例(1例卒中),冷冻球囊消融组发生2例(心脏压塞)。
EQ-5D-5L综合评分和视觉模拟量表评估显示两组3个月和12个月生活质量相似(表3)。
6.讨论
对于有症状的阵发性房颤患者,PFA在预防房性心律失常复发方面不劣于冷冻球囊消融,并且在1年内房性心律失常复发率较低。在意向治疗和符合方案人群中,PFA组的复发率较低,特别是在空白期内(第1天至第90天)组间差异更为明显。
安全性结局在两组之间相似,每组均有少数严重不良事件。PFA的选择性能量传递和较短的消融时间可能在安全性和有效性上优于冷冻球囊消融。未观察到PFA相关的能量并发症,如肺静脉狭窄、持续膈神经麻痹或食管心房瘘,这与大型观察性研究和ADVENT试验的结果一致【12,13】。
通过植入式心脏监测器进行心律监测,能够更全面地评估消融效果【14】。约有一半接受冷冻球囊消融治疗的患者在术后出现房性心动过速复发,这一结果与之前使用连续心律监测的试验结果一致【2,6,15】。
7.结论
在消融后第91天至第365天之间,PFA组中有39名患者出现房性心动过速复发,而冷冻球囊消融组中有53名患者出现复发, Kaplan–Meier累积发生率分别为37.1%和50.7%,PFA组优于冷冻组(组间差异为-13.6%;95% CI -26.9至-0.3;非劣效性检验P<0.001,优效性检验P=0.046)。安全性终点事件发生在PFA组的1名患者(1.0%)和冷冻球囊消融组的2名患者(1.9%)。
参考文献:⇅ 向上滑动阅览