
经导管主动脉瓣植入术(TAVI)已成为症状性重度主动脉瓣狭窄(AS)患者的标准治疗,覆盖从低风险到极高风险的全人群。随着TAVI技术向年轻、低危患者扩展及手术量激增,术后并发症的管理成为提升疗效的关键。本文结合《EuroIntervention》最新综述,聚焦 TAVI 术后两大核心并发症 ——卒中与传导异常,原文呈现最新TAVI 的并发症并了解其处理方法,为临床实践提供循证指导。

经导管主动脉瓣植入术(TAVI)
TAVI已成为从低风险到高风险的全风险谱系中症状性重度主动脉瓣狭窄(AS)患者的标准治疗选择。随着TAVI向低风险、年轻患者的应用扩展及手术量剧增,认识到 TAVI 的并发症并了解其处理方法至关重要。以下重点讨论TAVI术后重要并发症及其处理策略(表1,中心插图)。
表1. TAVI术后并发症、预防策略及治疗总结
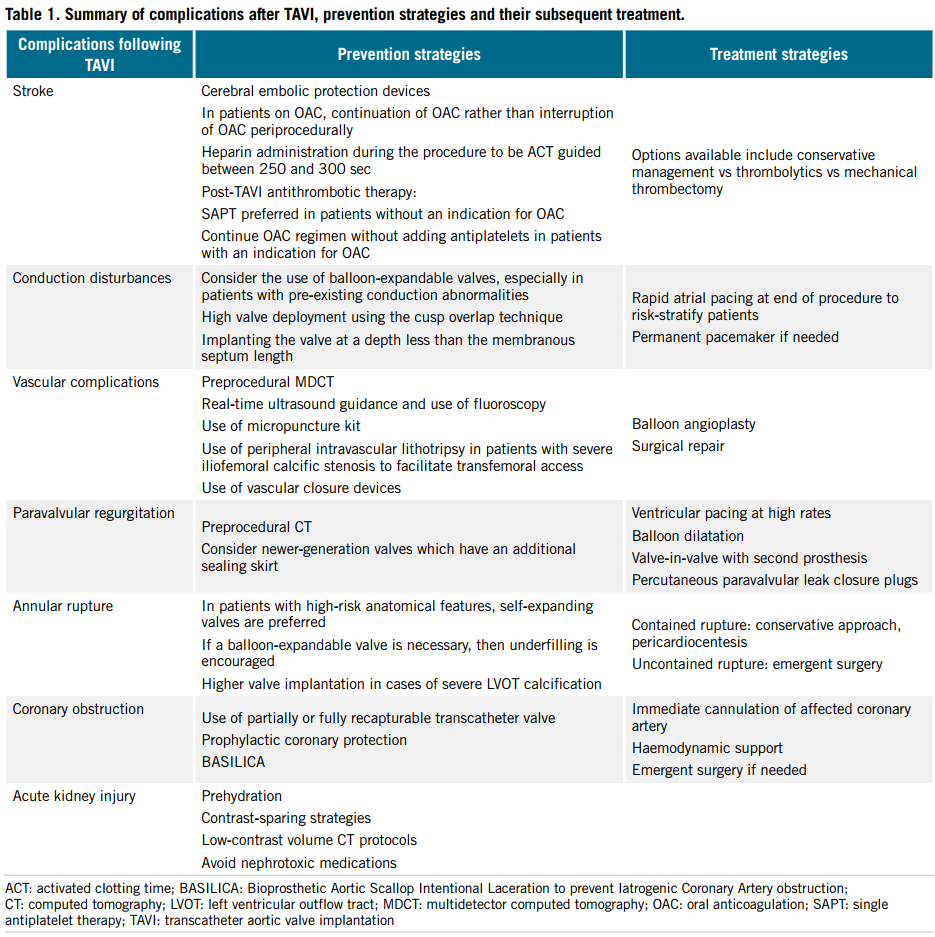
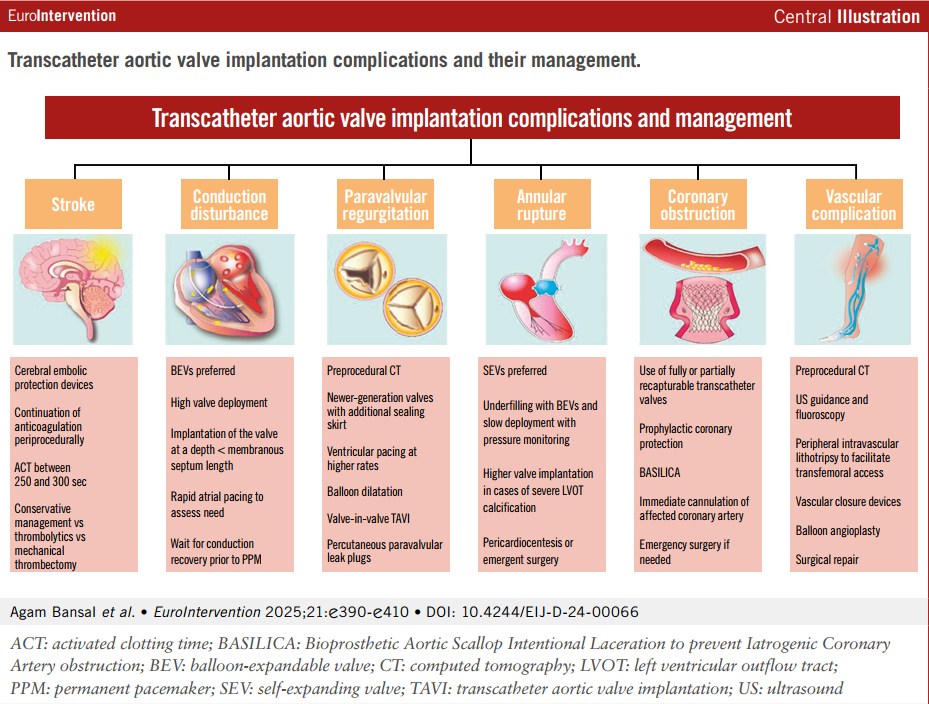
中心插图:经导管主动脉瓣植入术并发症及处理
一、卒中
术后卒中仍是TAVI最危险的并发症之一。其重要危险因素包括脑血管病史、高龄、外周血管疾病、房颤、手术时间较长及需球囊后扩张。美国胸外科医师协会(STS)/美国心脏病学会(ACC)经导管瓣膜治疗(TVT)登记研究纳入了超10万例患者的分析显示,TAVI术后卒中总发生率为2.3%,2011-2017年间基本没有变化。卒中发生与TAVI术后30天死亡率增加6倍相关。
卒中的预防
大多数TAVI相关卒中发生于围手术期(约72小时内),主要由瓣膜或血管碎屑栓塞引起。脑栓塞保护装置(CEPD)旨在捕获碎屑,从而降低围术期卒中发生率。目前唯一获美国食品药品监督处理局(FDA)批准的CEPD是SENTINEL系统(波士顿科学)。其应用已在单中心研究、TVT登记研究、行政数据库及一项随机临床试验(PROTECTED TAVR)中评估。PROTECTED TAVR试验纳入3,000例患者,结果显示,在 TAVI 术后 72 小时内,CEPD组与对照组间围术期卒中发生率无显著差异(2.3% vs 2.9%,差值-0.6个百分点,95%置信区间:-1.7至0.5;p=0.30)。尽管试验未针对致残性卒中设计,但CEPD组致残性卒中发生率更低(0.5% vs 1.3%)。一项全国数据库分析显示,使用CEPD的TAVI患者卒中后死亡率显著低于未使用者(6.6% vs 11.8%;p=0.02)。其他CEPD系统(如TriGUARD,Keystone Heart)已在欧洲获批,表 2 总结了在 TAVI 人群中使用的各种 CEPD 系统的安全性和有效性的现有证据。
表2. 不同CEPD的安全性及有效性证据总结
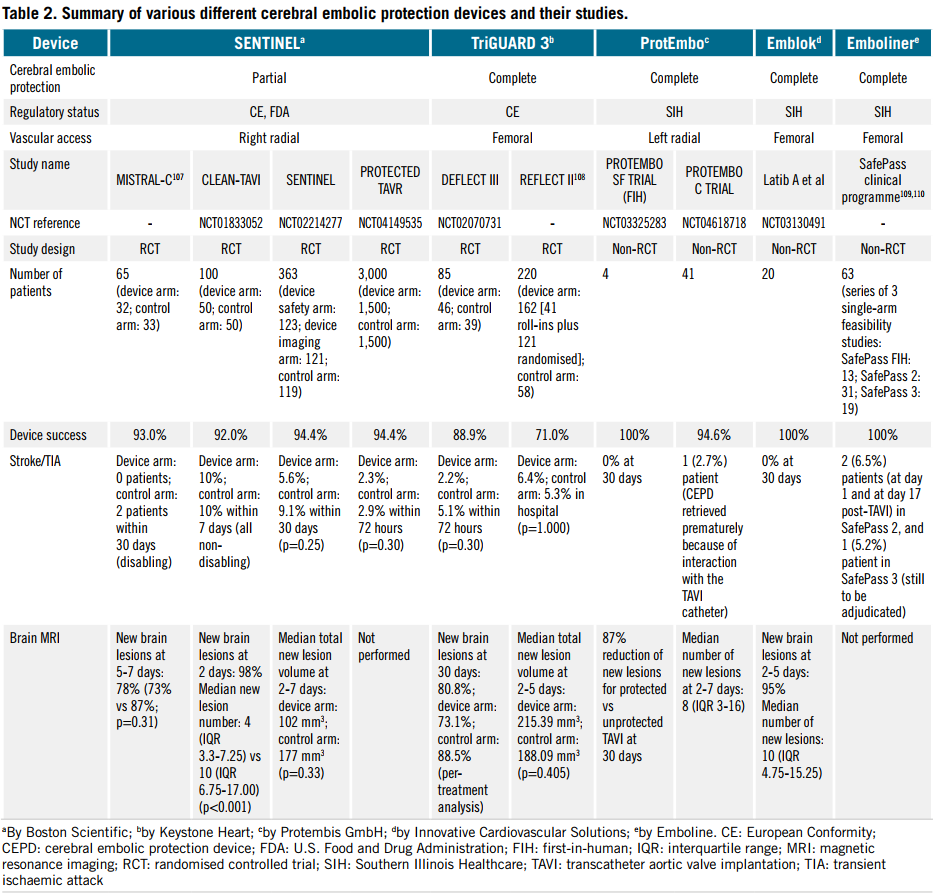
与围手术期脑血管事件相关的其他考虑因素包括权衡血栓形成和出血的竞争风险,包括药物治疗和围手术期抗凝治疗,以及辅助装置治疗。一项研究评估了TAVI术后围手术期继续抗凝与中断抗凝的安全性和疗效,结果表明继续抗凝组的卒中和输血风险较低。使用肝素减少围手术期血栓形成通常由活化凝血时间(ACT)指导,目标为250 ~ 300 s。在手术结束时,经常给予鱼精蛋白以逆转肝素,这已被证明可降低危及生命的出血和大出血的发生率,而不增加卒中和心肌梗死的发生率。目前尚不清楚肝素逆转是否会增加基线卒中风险高患者的围手术期脑血管事件发生率。
TAVI术后急性缺血性卒中的治疗
关于TAVI术后急性缺血性卒中紧急处理的数据极其有限。Vizient临床数据库报告了1,135例TAVI术后急性缺血性卒中患者的结局,其中90.2%(N=1,031)接受保守治疗,4.8%(N=54)接受溶栓治疗,4.4%(N=50)接受机械取栓。住院死亡率分别为7.7%、13.0%和22.0%。作者认为干预组死亡率较高可能与选择偏倚有关。Levi等利用国际多中心登记研究比较TAVI术后卒中保守治疗与积极干预(包括机械血栓切除术或溶栓治疗)的结局,尽管样本量小,但积极干预与90天无残疾生存率增加3倍相关。由于积极干预获益高度依赖症状发作时间(即“时间就是大脑”),因此早期识别卒中症状至关重要。采用有意识镇静而非全身麻醉有助于评估患者反应,可能有助于更早发现卒中。图1提出了TAVI术后卒中处理建议流程。
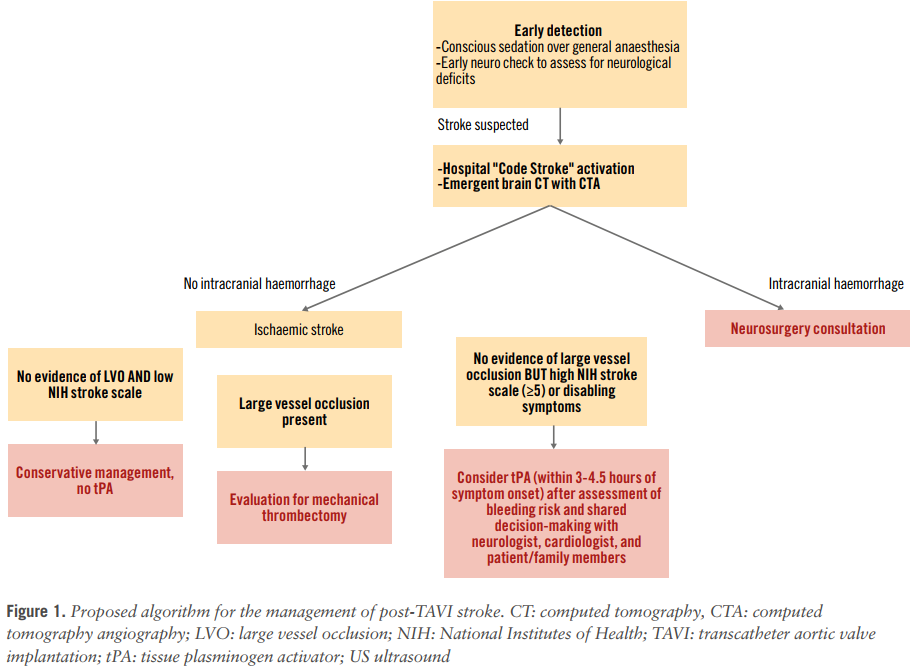
图1. TAVI术后卒中处理建议流程
二、传导异常
需植入永久性起搏器(PPM)的传导异常和新发左束支传导阻滞(LBBB)仍是TAVI最常见并发症。图2展示了左束支与主动脉瓣(AV)瓣叶之间的解剖关系,表明左束支的上束支位于右冠瓣最低点。新一代瓣膜TAVI术后PPM植入率差异较大(2.3%-36.1%)。TAVI术前右束支传导阻滞(RBBB)是术后PPM植入的最强ECG预测因素。其他ECG危险因素包括左前分支传导阻滞、一度房室传导阻滞(AVB)和LBBB。在瓣膜选择方面,自膨式瓣膜(SEV)较球扩式瓣膜(BEV)的新发围术期LBBB和PPM需求更高。解剖预测因素包括主动脉瓣环下方及左室流出道(LVOT)钙化的存在、瓣膜植入深度较低、膜部间隔长度(主动脉瓣环平面与希氏束距离)较短。此外,瓣中瓣(ViV)患者PPM植入率较低,可能与外科瓣膜的坚固结构限制了传导系统受压有关,而重复TAVI(redo-TAVI)中由于初始TAVI框架相对柔顺,可能不适用此结论。
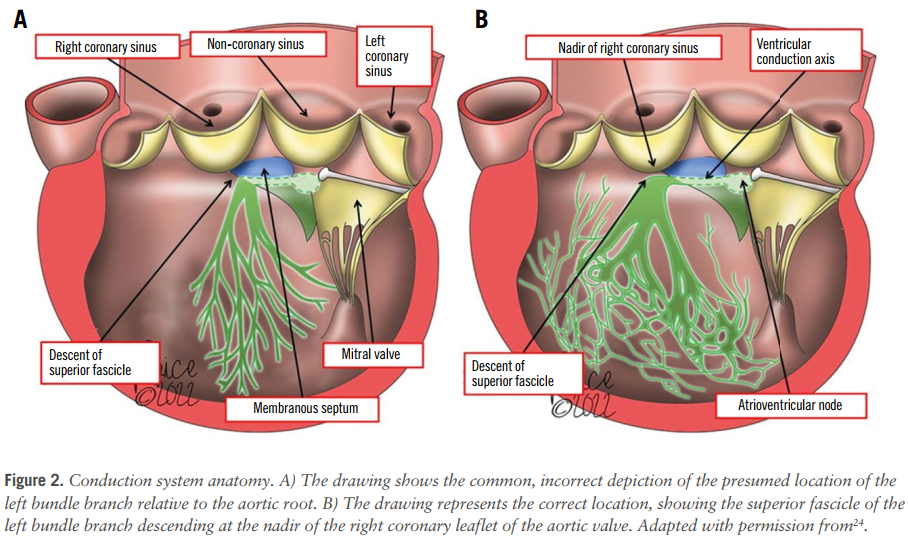
图2. 传导系统解剖示意图
传导异常的预防
鉴于SEV 的PPM植入风险较高,尤其对于已有RBBB患者,可考虑选择BEV。若因术者经验或解剖因素需使用自膨式瓣膜,应注意,最新一代SEV(如ACURATE neo2)因径向支撑力较低,PPM植入率相对较低。此外,开发了旨在实现更高植入深度的手术方式,无论使用 BEV 还是 SEV。
使用SAPIEN S3 BEV的高植入技术(HDT)隔离无冠窦(NCC)以使植入深度最小化,显著降低了PPM植入率(5.5% vs 13.1%;p<0.001)。该技术又称“窦部重叠技术”, 通过将C臂旋转至右前斜(RAO)足侧方向来实现;最佳投影可以从术前计算机断层摄影(CT)确定,或在手术过程中通过“消除”经导管心脏瓣膜(THV)支架框架呈方形的任何视差来实现。该投影的关键优势在于,可以对齐输送导管和主动脉瓣,消除输送导管的视差,避免LVOT缩短(如在左前斜位),从而允许更精确和更高的植入深度。该技术还证明了与 SEV 的 PPM 植入率降低相关。在 MIDAS 研究中, CT测量膜部间隔长度,瓣膜植入深度小于该长度可使PPM植入率从9.7%降至3.0%,新发LBBB率从25.8%降至9.0%。此外,预测PPM植入的评分系统亦可使用,如PRIME评分和Emory评分(仅适用于BEV)。
传导异常的治疗
我们机构常规在术后进行快速右房(RA)起搏研究,将临时起搏电极撤回至RA,以70-120次/分(每次递增10次/分)进行起搏,评估患者风险。在较低频率下出现文氏现象者、房颤无法行起搏研究患者及术后出现高度AVB者需个体化决策,结合围术期ECG变化、解剖因素以及其他可以指导继续住院或门诊心律监测的变量(图3)。对284例TAVI患者的研究中,130例(46%)出现起搏诱导文氏现象,未出现者仅1.3%需PPM植入,阴性预测值98.7%。
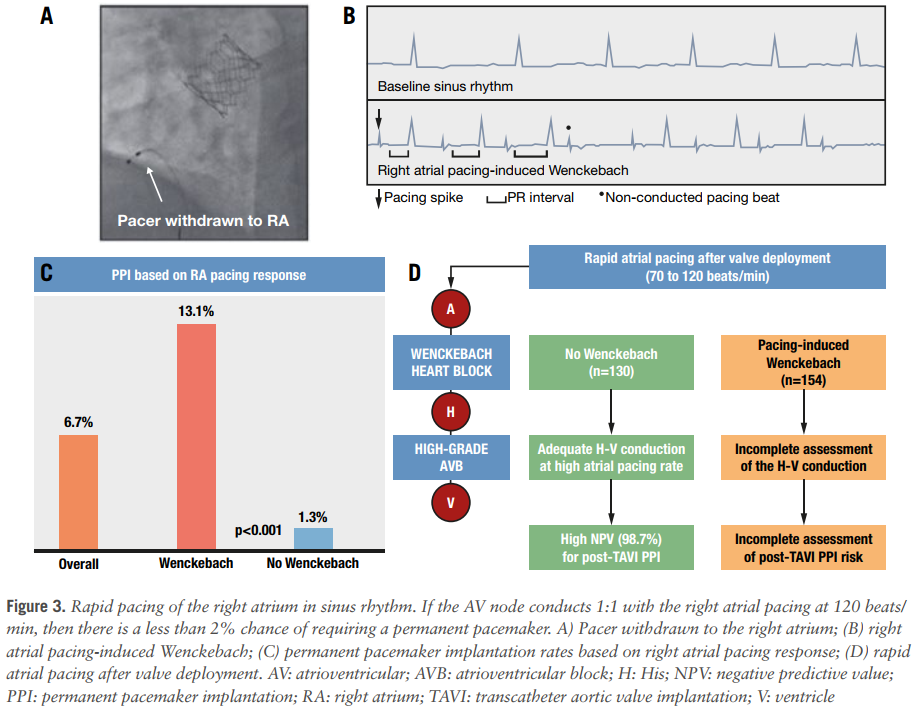
图3.右心房快速起搏。
专家小组提出了TAVI术后传导异常处理流程:
(未完待续)