
中南大学湘雅二医院
朱兆伟教授

文章题目:
经导管主动脉瓣置换术(TAVR)治疗瓣膜保留性主动脉根部置换术(VSARR)后主动脉关闭不全(AR):病例系列研究
文章来源:
European Heart Journal - Case Reports (2025) 9, ytae674

点评专家:
上海市胸科医院 朱丹教授
瓣膜保留性主动脉根部置换术(Valve-Sparing Aortic Root Replacement, VSARR)是一种用于治疗主动脉根部扩张和主动脉关闭不全(Aortic Regurgitation, AR)的手术方法,能够保留患者自身的主动脉瓣。然而,部分患者术后可能会出现AR复发,而二次开胸手术风险较高。经导管主动脉瓣置换术(Transcatheter Aortic Valve Replacement, TAVR)可作为一种替代方案,但目前关于如何优化手术策略的文献较少。

本文报告了两例在 VSARR(David 手术)后出现严重 AR 的病例。两例患者的 CT 结果均显示无钙化的主动脉瓣及狭窄的 Valsalva 窦。由于二次手术风险过高,均选择了球囊扩张型经导管主动脉瓣(Balloon-Expandable Transcatheter Heart Valve, THV)进行 TAVR 治疗。在手术过程中,瓣膜大小由 CT 测量确定,并在球囊测试的基础上进行适度的过度扩张(10%–11%)。术后主动脉造影及超声心动图结果显示无瓣上或瓣周反流。两名患者均顺利出院,随访 CT 证实瓣膜无移位,冠状动脉通路保持良好,同时为未来可能的 TAVR 再次介入提供了条件。
在无主动脉瓣钙化的情况下,TAVR 仍可成功应用于 VSARR 后的 AR 治疗。适度的 THV 过度扩张(10%–11%)是安全且有效的。建议在手术前使用球囊测试以确保足够的锚定力,而不必进行过度扩张,以降低瓣周反流和缝合处破裂的风险。
主动脉根部扩张(Aortic Root Dilation)但无严重主动脉瓣病变的患者可通过 VSARR 手术进行治疗。该术式利用 Dacron 血管移植物替换主动脉根部,同时重新植入冠状动脉,并保留患者自身的主动脉瓣。
1970 年代,Yacoub 率先提出了主动脉根部“重塑”(remodeling)技术,该方法使用 3 片聚酯材料制成的瓣周支架替换 Valsalva 窦,保留主动脉瓣,但无法防止瓣环扩张。10 年后,Tirone David 及其团队改进了该技术,提出重新植入术(reimplantation procedure),将 Dacron 移植物置于主动脉瓣叶下方,以稳定瓣叶并防止瓣环扩张。
VSARR 具有避免抗凝治疗、降低机械瓣相关并发症(如血栓栓塞、瓣膜失效)等优势,因而受到青睐。然而,VSARR 术后可能会出现 AR 复发,约 10% 的患者需要在 8 年内接受再次介入治疗。
由于 TAVR 具有微创、术后恢复快、手术风险低的优点,部分 VSARR 术后 AR 的患者被考虑进行 TAVR 治疗。然而,由于术后瓣叶无钙化,TAVR 植入时可能会面临瓣膜稳定性差、移位或栓塞风险增加、瓣周反流风险升高等挑战。因此,目前关于 VSARR 术后 TAVR 的研究较少,如何选择合适的经导管瓣膜(THV)和确定最佳的尺寸策略仍不明确。
病例1
一名 68 岁女性患者因主动脉根部扩张(Valsalva 窦直径 59 mm)和中度主动脉关闭不全(AR),于 2020 年接受瓣膜保留性主动脉根部置换术(VSARR,David 手术),植入30 mm Vascutek Valsalva 血管移植物(Terumo, 东京,日本),并同时接受外科房颤消融术。
术前超声心动图(TTE)显示,该患者的原生主动脉瓣为三叶瓣,瓣叶轻度增厚但无钙化,同时左心室(LV)功能受损,射血分数(LVEF)为 45%。冠状动脉造影未见明显冠状动脉病变。术后,该患者出现心输出量下降,冠状动脉造影提示右冠状动脉(RCA)开口医源性狭窄,可能是右冠纽扣(coronary button)重新植入时造成的。随后,患者接受了再次开胸手术,并采用大隐静脉移植至 RCA 进行血运重建。术后TTE显示,患者左心室功能严重受损(LVEF 30%),并存在中度 AR。
2023 年,患者因呼吸困难再次就诊,TTE 评估显示严重 AR,左心室功能进一步恶化,LVEF 仅为 15%(图1)。CT 评估显示主动脉瓣无钙化,新生瓣环(neo-annulus)面积为 660 mm²,左冠状动脉开口高度较低,仅 7.1 mm(图2)。Valsalva 窦较狭窄,平均直径 31 mm,窦管连接区(STJ)同样狭窄(28 mm),高度为 24 mm。由于二次开胸手术风险较高,心脏团队一致同意采用经导管主动脉瓣置换术(TAVR)。患者的瓣环过大,无法使用 27 mm Trilogy 瓣膜,因此选择了球囊扩张型经导管瓣膜(THV),主要考虑其良好的冠状动脉通路可及性,并且适用于未来可能的二次 TAVR 介入。
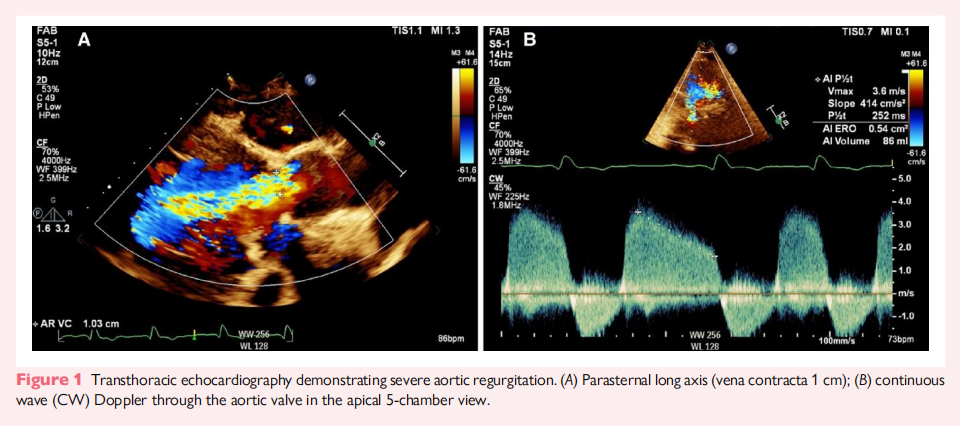

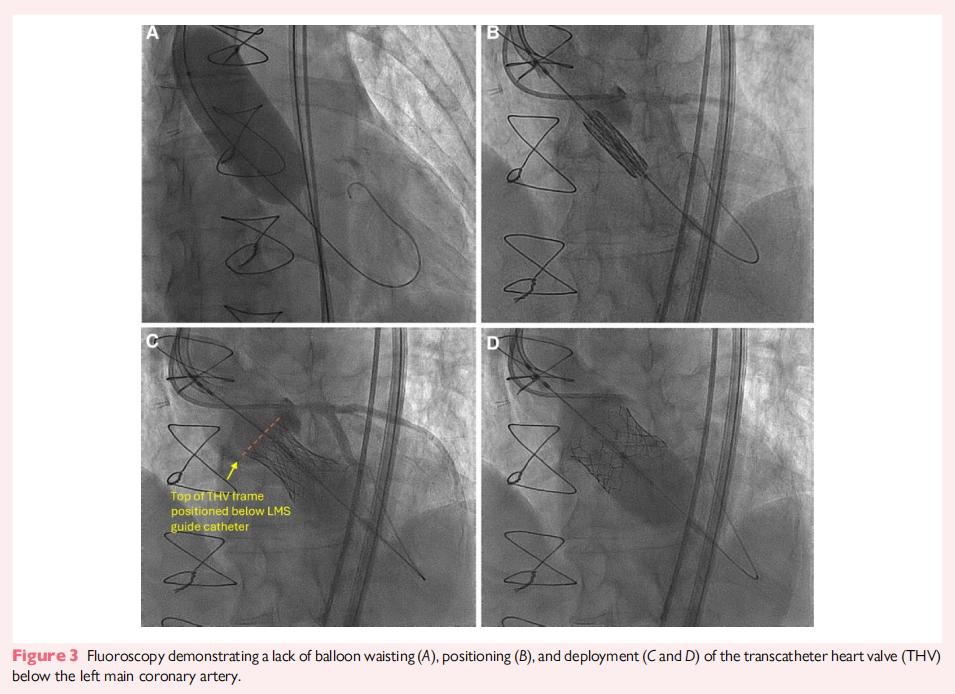
2023 年 7 月,患者接受了经股动脉 TAVR 手术。为了指导瓣膜尺寸选择,术中使用28 mm Cristal 球囊(Balt, Montmorency, 法国)在快速起搏状态下扩张新生瓣环。球囊完全扩张后固定良好,但未出现明显的腰缩(waisting)。鉴于28 mm Cristal 球囊在瓣环内稳定但无腰缩,最终选择了29 mm Sapien 3 瓣膜(Edwards Lifesciences, 加利福尼亚,美国),并额外充盈 3 cc,以达到 730 mm² 的覆盖面积(估算过度扩张 11%)。术中,左冠状动脉主干(LMCA)通过导管标记,以确保瓣膜植入时不会影响冠状动脉通路(图3)。随后,将导丝送入左前降支(LAD),并在 LAD 内放置冠状动脉球囊,以稳定导管。THV 瓣膜最终被植入左冠状动脉下方,以保持冠状动脉通畅,并为未来可能的TAVR 再次介入提供条件。术后主动脉造影显示无主动脉关闭不全(AR),瓣膜仅有轻微的腰缩。术后患者发生完全性房室传导阻滞,因此植入了永久性心脏起搏器。术后 3 个月随访TTE 评估显示,瓣膜功能良好,无瓣上或瓣周反流,主动脉瓣口面积 2.2 cm²,平均跨瓣压差 7 mmHg。CT 复查显示瓣膜位置稳定,无移位,且仍然位于左冠状动脉开口下方(图4)。

患者左心室功能仍然较差,后续已将起搏器升级为心脏再同步治疗(CRT)设备。
病例2
一名 71 岁男性患者因主动脉根部扩张和严重主动脉关闭不全(AR),于 2021 年接受瓣膜保留性主动脉根部置换术(VSARR,David 手术),植入26 mm Vascutek Gelwave Valsalva 血管移植物(Terumo),并进行了冠状动脉重新植入术。术中发现该患者主动脉瓣为三叶瓣,无钙化。术后TTE 评估显示左心室大小及功能正常,仅有轻度 AR。
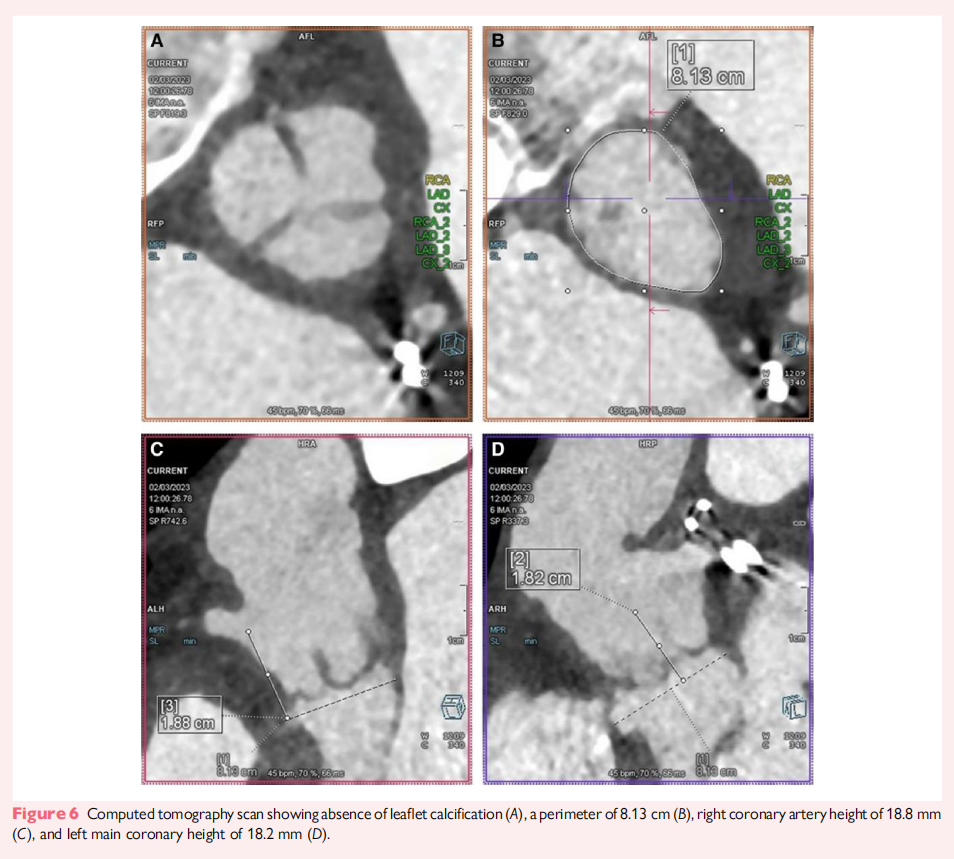
2022 年,该患者出现进行性呼吸困难和周围水肿。经食道超声心动图(TEE)发现右冠瓣脱垂导致严重 AR,左心室轻度扩张,收缩功能良好(LVEF 67%)(图5)。由于二次开胸手术风险较高,心脏团队一致同意采用TAVR。CT 评估显示新生瓣环面积 525 mm²,左冠状动脉主干(LMCA)开口高度 18.2 mm,右冠状动脉(RCA)开口高度 18.8 mm(图6)。Valsalva 窦及 STJ 均较狭窄(28 mm 和 25 mm),STJ 处存在“扭曲”,STJ 高度 21 mm(图6D)。由于Trilogy JenaValve 瓣膜供应短缺,决定采用经股动脉 TAVR,植入 26 mm Edwards Sapien Ultra 瓣膜。

2023 年 6 月,术中使用25 mm Edwards 球囊在瓣环处进行扩张试验,球囊固定良好,未出现腰缩。最终选用26 mm Sapien S3 Ultra 瓣膜,额外充盈 4 cc,以达到 580 mm²(估算过度扩张 10%)。由于患者冠状窦狭窄且 STJ 处存在扭曲,为避免影响冠状动脉通路,THV 瓣膜植入于左冠状动脉下方(图7)。术后主动脉造影及超声心动图均显示无主动脉关闭不全(AR)。术后心电图提示新发左束支传导阻滞。

术后随访

VSARR 术后 AR 罕见但治疗困难。TAVR 在此类患者中的挑战包括:
1.无钙化的瓣叶:减少了瓣膜的固定点,增加移位风险。
2.Valsalva 窦和窦管连接区狭窄:可能影响瓣膜定位和冠状动脉通路。
3.瓣膜选择和尺寸确定:本研究建议使用球囊扩张型瓣膜,并进行 10%–11% 的适度过度扩张,以降低移位风险。
证明了 TAVR 可用于 VSARR 术后 AR 治疗,且效果良好。
建议术前 CT 精准评估,术中采用球囊测试以优化瓣膜尺寸。
采用短框架瓣膜可提高冠状动脉通路可及性,适用于未来的 TAVR 介入。
1.提供更强的锚定力:相比于自膨式瓣膜,球囊扩张型瓣膜在无钙化瓣叶的患者中固定更稳定,降低了术后移位和栓塞的风险。
2.精确的尺寸控制:通过术中球囊测试,能够实现精准的过度扩张(10%–11%),既保证了瓣膜的稳定性,又避免了过度扩张导致的缝合处破裂风险。
3.更好的冠状动脉通路可及性:短框架设计有助于避免冠状动脉阻塞,确保未来的 TAVR 介入可行性。
4.适用于未来的二次 TAVR 介入:球囊扩张型瓣膜设计使其在后续需要再次介入时更易于植入新瓣膜。
VSARR 术后 AR 可用 TAVR 进行治疗,但需关注瓣膜固定问题。
采用球囊扩张型瓣膜,并适度过度扩张 10%–11%,可提高成功率。
术前CT 评估和术中球囊测试是关键,确保瓣膜锚定良好。
选用短框架瓣膜可提高冠状动脉通路可及性,利于未来 TAVR。
TAVR 可作为 VSARR 术后严重 AR 的微创治疗方案。球囊扩张型瓣膜在此类患者中的应用表现出更强的锚定力、更优的冠状动脉通路管理及更好的未来介入可行性。合理的瓣膜选择和优化的手术策略是成功的关键,未来仍需更多研究验证其长期疗效。
朱丹教授(上海市胸科医院)
本研究为TAVR在VSARR术后AR患者中的应用提供一个可行的治疗策略,尤其验证了短支架球囊扩张型瓣膜(BEV)在用人工血管行保留瓣叶主动脉根部置换后瓣叶无钙化环境下的适应性。
研究结果充分证明,BEV 依靠其精准可控的扩张方式,在确保稳定锚定的同时,能够有效避免瓣周反流和移位问题。值得强调的是,研究团队采用的术前影像精准测量结合术中球囊测试,为瓣膜大小选择及植入策略提供了有力支撑,确保了手术的可预测性和安全性。从 TAVR 技术的发展趋势来看,BEV 在复杂病变中的应用潜力愈发凸显,尤其在解剖结构特殊的情况下,其更精准的扩张控制、更稳定的锚定机制及更优的远期可及性,使其成为该类病例的优选方案。本研究虽样本量有限,但在策略优化、技术细节及术后效果评估上均具有很高的临床价值,为未来 BEV 在更广泛适应证中的应用提供了有力支持。
