
经导管主动脉瓣置换术(TAVR)彻底改变了所有外科手术风险级别的严重主动脉瓣狭窄患者的治疗方式。虽然主动脉夹层、穿刺部位损伤、瓣膜栓塞和主动脉瓣环破裂等严重并发症较为罕见,但它们会导致显著的死亡率。心包填塞虽然不常见,但死亡率很高,尤其是当其由瓣环损伤引起时。心包填塞的治疗通常需要心包穿刺术或外科手术干预,但由于接受TAVR的患者手术风险较高,这些治疗可能具有挑战性。目前,关于TAVR术后心包填塞的发病率和管理的文献较少。《Struct Heart》发表了一篇来自克利夫兰的研究“Outcomes of Cardiac Tamponade Post-Transcatheter Aortic Valve Replacement: Results From a Tertiary Cardiac Center”,该研究揭示了TAVR术后心包填塞的时间趋势,并报告其在当代真实世界的发病率和管理情况。

本文要点
• 心包填塞是经导管主动脉瓣置换术后的罕见并发症,本研究队列中的发病率较低。
• 大多数病例在术中被发现,且由主动脉瓣环损伤引起。术后心包填塞最常见于右心室损伤。
• 经导管主动脉瓣置换术后心包填塞患者的结局良好。这表明需要心脏团队仔细选择患者,利用多模态成像进行适当的术前规划。

经导管主动脉瓣置换术后心包填塞的结局
方法
本研究为一项单中心回顾性观察研究,旨在评估三级医疗机构TAVR术后心包填塞的发病率及其管理情况。通过手术病例描述确定这些病例中心包填塞的病因。在克利夫兰诊所主动脉瓣中心TAVR数据库中, 选取2013年1月至2019年1月期间所有经过心脏团队评估后接受TAVR的患者。共确定了2030例TAVR病例。心包填塞被定义为由于心包积液导致心脏腔室缓慢或快速受压的危及生命的事件。
通过回顾电子病历,收集了患者的临床、影像学、手术特征及随访数据。收集的临床特征包括年龄、性别、种族、临床症状(心绞痛和晕厥)、体重指数、糖尿病、吸烟史、瓷化主动脉、高血压、终末期肾病、外周血管疾病、中风或短暂性脑缺血发作、右/左心室大小(RV/LV)和功能、既往冠状动脉旁路移植术/经皮冠状动脉介入治疗史以及心脏内装置。手术特征包括麻醉类型、穿刺部位和鞘管尺寸、临时起搏器电极类型、瓣膜类型(球囊扩张式或自膨胀式瓣膜)、瓣中瓣TAVR的生物瓣膜类型、导丝以及术前/术后扩张情况。
鉴于心包填塞并发症的潜在致命性,主要终点为TAVR术后30天内的全因死亡。次要终点包括需要心脏手术、休克、急性肾损伤、需要永久起搏器植入以及院内死亡。心包填塞的病因由两名经验丰富医师通过回顾手术影像、病历以及(如有)引流液进行回顾性确认。
对于心包填塞病例,再次回顾了术前CT,以评估钙化程度。瓣环和主动脉根部测量通常在收缩期(20-30%)阶段进行。以定量和定性方法评估钙化负荷:使用容积技术评估钙化程度,并采用Agatston方法确定平均钙化评分。
结果
基线特征
在2030例因严重主动脉瓣狭窄接受TAVR的患者中,有20例(0.9%)发生心包填塞的患者。基线特征总结于表1。如预期所示,接受TAVR的患者均为老年人,Society of Thoracic Surgeons(STS)评分平均为6.8 ± 3.5。近一半的患者有吸烟史,超过80%的患者患有高血压,三分之二的患者患有糖尿病。
表 1. TAVR 后发生心包填塞患者的基线特征


发生心包填塞的患者平均年龄为81.7岁,合并症发生率较高。20%(n = 4)的心包填塞患者长期服用免疫抑制剂类固醇。20%(n = 4)的患者患有外周动脉疾病,其中2例患者的解剖结构不适合经股动脉TAVR;1例患者采用锁骨下动脉入路,另一例患者采用经腔静脉TAVR。表2提供了麻醉和设备(包括瓣膜类型和尺寸以及导丝)的详细信息。
表2.TAVR术后心包填塞患者的手术概况及并发症详情


影像学特征
超声心动图参数记录于表3并进行比较。除两名患者外,其余患者均接受了对比增强心脏CT。当无法进行心脏CT时,则采用心脏磁共振成像进行瓣环测量。85%的病例为重度主动脉瓣钙化,15%的病例为中度。所有患者均存在严重的瓣叶钙化,60%的患者(n=12)还存在着陆区钙化。着陆区钙化最常见于左冠窦(58.3%),其次是左冠窦与无冠窦的组合。平均主动脉瓣钙化评分为2566.2 ± 1223.2 Agatston单位,着陆区钙化评分为408.3 ± 824.8 Agatston单位(表2)。
表3.经导管主动脉瓣置换术(TAVR)患者中有心包填塞与无心包填塞的超声心动图特征


心包填塞的发生时间
大多数病例在术中观察到心包填塞(n=14;78.5%为左心损伤,21.4%为右心损伤)。少数病例(n=6;16.6%为左侧,83.3%为右侧)发生在术后(图1)。所有无需外科修复的术中发生心包填塞的患者均被转至心脏重症监护室,平均监护时间为3.61 ± 1.5天,平均住院时间为9.15 ± 6.3天。

图1.TAVR患者心包填塞的病因
缩写:LV,左心室;RV,右心室;TAVR,经导管主动脉瓣置换术。
根据推测的损伤部位进行的手术细节分析
瓣环损伤
50%(n=10)的病例中,术中发生心包填塞是由于瓣环损伤所致。一名患者在用23mmEdwards瓣膜球囊进行后扩张后发生瓣环破裂。另一名患者通过锁骨下入路行TAVR手术,植入29mmMedtronic Evolut CoreValve瓣膜,因严重瓣周漏(需后扩张)而需植入第二个Evolut(29mm)瓣膜,之后患者出现严重低血压,并出现心包填塞征象,需紧急行心包穿刺术。尽管如此,患者仍血流动力学不稳定,接受静脉-动脉体外膜肺氧合(ECMO),但不幸死亡。另一名患者发生EdwardsSAPIEN XT(ES-XT)瓣膜上移,导致瓣膜处于瓣上位置;成功在原瓣膜内且更靠近心室侧植入第二个瓣膜后,患者出现低血压、奇脉以及中度心包积液伴心包填塞,需行心包穿刺术。
左心室损伤
两名患者因左心室损伤而发生心包填塞,均发生在瓣膜植入后(ES-S3和ES-XT)。两名患者均行急诊开胸术,用自体心包修补左心室侧壁小撕裂口,并清除心包血肿。
右心室损伤
右心室(RV)撕裂常(8例;40%)被确定为心包填塞的原因。三名患者在放置临时起搏器时发生右心室撕裂(一例为放置临时起搏器螺旋电极以治疗术中完全性房室传导阻滞,另两例为放置临时起搏器主动固定电极)。其余五例患者在术后数小时发生心包填塞。心包引流液评估显示均为静脉血。
转归
大多数患者(95%;n=19)需行心包引流(图2)。所有患者均通过剑突下入路行心包穿刺术,平均引流血量为260.5 ± 210ml(视频1)。平均输注3.5 ± 3.2单位浓缩红细胞,大多数患者(65%;n=13)通过股静脉鞘管对引流的心包血进行自体输血(图3)。急性肾损伤(30%)和升压药需求(50%)的发生率较高,但只有5%的患者需要血液透析。

图2.TAVR过程中发生的瓣环破裂伴心包填塞及其处理。
视频显示的是重度钙化瓣环的CT图像,同时可见严重的左心室流出道钙化。测得瓣膜面积为0.59平方厘米。鉴于钙化的范围和形态,选择了自膨式瓣膜。在球囊后扩张后,患者出现急性心包填塞,经急诊超声心动图证实(在胸骨旁长轴切面显示大量心包积液,并伴有心包填塞临床表现)。患者在透视和超声心动图引导下成功接受了剑突下心包穿刺术。
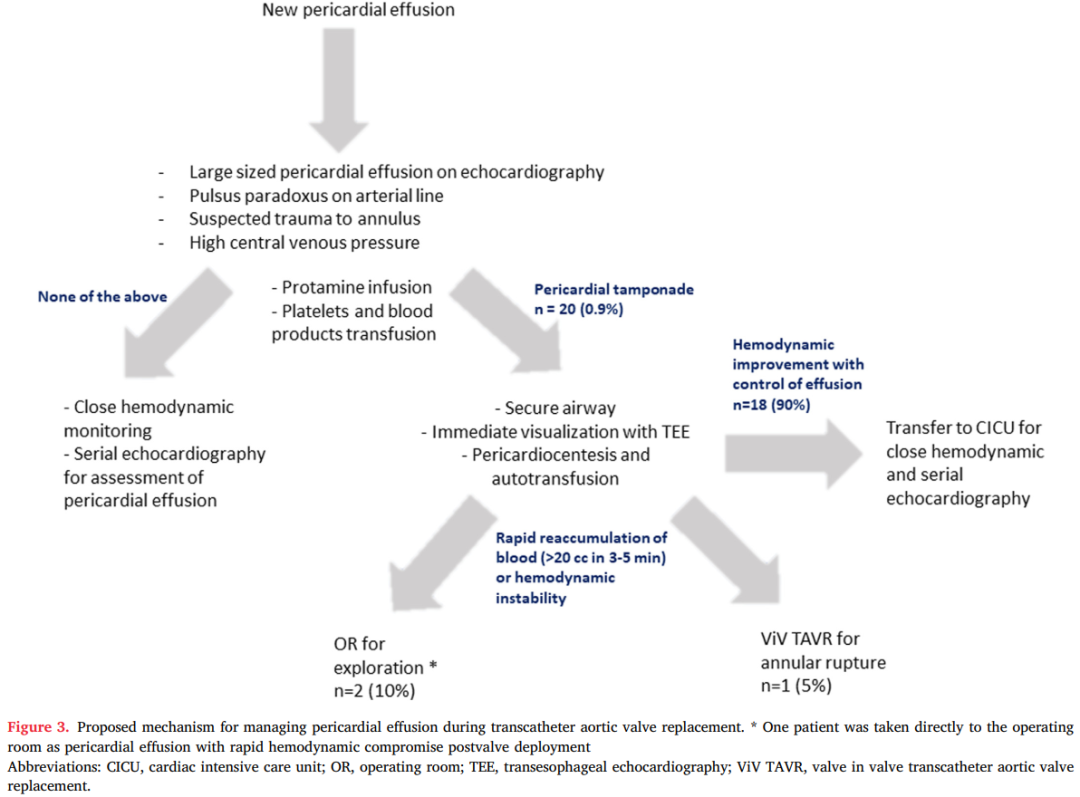
图3.TAVR 期间心包积液的管理机制建议。
*一例患者因瓣膜释放后心包积液伴快速血流动力学恶化而被直接送入手术室。
缩写:CICU,心脏重症监护室;OR,手术室;TEE,经食管超声心动图;ViV TAVR,瓣中瓣经导管主动脉瓣置换术。
TAVR术后的抗血小板和抗凝治疗因人而异;31.5%(n=6)的患者使用单一抗血小板药物(5例使用阿司匹林,1例使用氯吡格雷),42.1%(n=8)的患者使用双联抗血小板药物策略(阿司匹林和氯吡格雷),10.5%(n=2)的患者使用抗凝治疗(华法林或阿哌沙班),15.7%(n=3)的患者出院时使用抗血小板和抗凝联合治疗策略(2例使用阿司匹林和华法林,1例使用阿司匹林和达比加群)。
除一名患者外,其余患者均存活出院,心脏并发症的详细情况记录于表2。在中位随访1126天(四分位距589,1710天)时,75%的患者存活(n=15)。一名患者院内死亡(5%),另一名患者在TAVR术后30天内院外死亡(5%),还有两名患者(10%)在TAVR术后1年内死亡。
讨论
本研究重点介绍了在高手术量医疗机构行经TAVR后发生心包填塞的转归。心包填塞的发生率较低(0.9%),且其中只有两名患者需要心脏外科手术(均因左心室撕裂)。在本研究队列中,仅记录到一例院内死亡病例。大多数患者是在术中被发现,且心包填塞是由瓣环损伤引起的。在导致心包填塞的右心室损伤病例中,更多是在术后发现的。
Rezq等人报道称,在2012年之前接受检查的TAVR患者中,心包填塞的发生率为4.3%(389例患者中有17例)。这一比率远高于我们当前的研究队列,这可能是由于经股动脉TAVR的比率更高以及手术技术的改进所致。一项对全美国住院患者样本的分析报告显示,2012年至2014年间心包并发症(心包填塞、心包穿刺术或心包开窗术的复合指标)的发生率为1.3%。另一项基于2012年1月至2015年9月全美国再入院数据库的报告发现,心包填塞的总发生率为0.9%。
医疗机构手术量对TAVR结果的影响已得到充分证实。上述再入院数据库分析显示,与中低手术量医疗机构相比,高手术量医疗机构因心包填塞导致的死亡率更低(19.1% vs. 36.1% vs. 26.7%,p < 0.001)。
在手术过程中早期识别心包填塞至关重要,而确定损伤的病因/部位则有助于后续治疗。在我们的队列中,很大一部分患者仅通过心包穿刺术进行了保守治疗。这一点尤为重要,因为与经皮或保守治疗相比,接受手术治疗的患者的预后通常较差,尤其是在本研究时期,即使是择期手术,患者也面临较高的风险。
心包填塞的两个重要病因是心室穿孔(左心室或右心室)和瓣环损伤。心室穿孔通常是由于左心室硬导丝或右心室临时起搏电极所致。随着使用改进左心室硬导丝和球囊头端右心室起搏电极的出现,预计未来报告中右心室穿孔的发生率将会降低。在我们的队列中,瓣环损伤是心包填塞最常见的病因,其次是因非球囊头端起搏电极(以及在一例中为螺旋电极)导致的右心室损伤。随后,我们使用了球囊头端右心室起搏电极,未再出现并发症。文献中报道的瓣环破裂的死亡率较高:局限性破裂为25%,完全性破裂为67%。已知的瓣环破裂危险因素包括主动脉瓣环直径<20mm、左心室肥厚、瓣膜选择过大以及严重的瓣环钙化。
仔细评估瓣环尺寸并选择合适的瓣膜对于预防瓣环损伤至关重要。在我们队列中,所有因瓣环破裂导致心包填塞的患者,其瓣膜水平、窦管交界处和着陆区均存在中至重度钙化。无冠窦下方的左心室流出道钙化通常是薄弱点,可能发生瓣环破裂。瓣环损伤通常发生在球扩式瓣膜植入过程中或自膨式瓣膜后扩张时。与TAVR术前瓣环尺寸相比,瓣膜选择过大至120%或更大,是使用球扩式瓣膜发生损伤的重要危险因素。在我们的队列中,大多数患者(85%;表2)接受了球扩式瓣膜治疗。对于严重钙化的瓣膜,一种考虑因素是相对于瓣环尺寸选择较小的器械,将球囊少充盈1ml或更多,可能是有益的。此外,评估植入过程中施加在瓣环上的压力可能有帮助,注意无论注射器中剩余的充气容量还剩多少,压力不要超过 6 个大气压。相应地,一些术者在瓣膜严重钙化的情况下更倾向于使用自膨式瓣膜,以降低瓣环破裂的风险,尽管使用较高的瓣膜支架,在必要时,进行瓣周漏封堵更为复杂,如本系列所示(表2),当需要瓣膜后扩张时,仍可能发生心包填塞。此外,自膨式瓣膜的后扩张通常使用保守的球囊直径。然而,瓣膜类型的选择取决于多种因素,包括冠状动脉口距瓣环的高度、术后完全性房室传导阻滞的风险以及瓣周漏的风险。一些术者还选择在全身麻醉和经食管超声心动图指导下进行具有高瓣环损伤风险的病例,以便在瓣膜扩张过程中“观察”瓣环平面的钙化移动情况,如果钙化似乎延伸至瓣环边缘过近,则停止充盈。
关于心室损伤,使用预塑形导丝可能有助于预防左心室损伤。然而,一名因左心室撕裂而导致心包填塞的患者是使用预塑形的Confida导丝(Medtronic, Minneapolis, MN)进行自膨式瓣膜治疗的。另一个提高安全性和预防潜在右心室穿孔的机会是使用导丝进行起搏,无论是使用典型的硬导丝还是专门为此目的设计的导丝(如OpSens SavvyWire)。
结论
从克利夫兰的经验来看,即使心包填塞是由瓣环损伤引起的,术后存活率也表明,对于大多数患者而言,通过心包引流进行保守治疗是一种合理的治疗选择。优化心包填塞的治疗流程至关重要。建议心脏瓣膜团队定期对这一并发症(鉴于其罕见性)进行专门的流程演练,以管理这些危及生命的并发症。