
肝素诱导的血小板减少症(HIT)是肝素类药物使用过程中可能出现的一种严重不良反应,其临床表现复杂且风险较高,若处理不当,可能导致严重的血栓栓塞事件甚至死亡。本文基于《肝素诱导的血小板减少症中国专家共识》,以可视化逻辑图为框架,为各位同道梳理HIT诊治的关键要点。
引言
HIT的发病机制涉及免疫反应,是在应用肝素类药物过程中出现的、由抗体介导的肝素不良反应,临床上以血小板计数降低为主要表现,可引发静、动脉血栓形成,严重者甚至导致死亡。其临床表现多样,诊断与治疗均具有一定挑战性。准确识别和及时干预对于改善患者预后至关重要。通过以下内容,我们将深入了解HIT的诊治要点,助力临床决策。
肝素诱导的血小板减少症概述
分类与发生率
HIT分为Ⅰ型和Ⅱ型。
HIT Ⅰ型为良性过程,发生率为10%~20%,通常发生在使用肝素后的1~2天,血小板计数轻度降低,一般不低于100×10⁹/L,不会导致血栓或出血事件,在不停用肝素类药物的情况下可自行恢复,不需要停药和特殊处理。
HIT Ⅱ型为免疫相关性,血小板计数显著降低、伴/不伴有严重血栓栓塞风险,其中血栓形成及栓塞并发症是导致HIT患者死亡和病残的主要原因,发生率约为0.1%~5%。外科手术后患者、心脏外科手术患者、癌症患者、重症患者等不同患者群体,HIT的发生率有所不同。除非特别说明,目前文献中、临床上所指的HIT是HIT Ⅱ型。
危险因素
HIT发生风险与多种因素有关,包括肝素类药物的类型、暴露时间、方式、剂量及治疗策略,以及患者人群、全身性炎症、创伤程度、性别等。例如,牛源性肝素高于猪源性肝素,治疗剂量可能高于预防剂量,接受普通肝素(UFH)高于低分子肝素(LMWH),外科患者高于内科患者,严重创伤接受外科大手术治疗患者HIT风险高于其他患者,女性患者高于男性患者。
病理生理机制
血小板第4因子(PF4)是天然的肝素灭活剂,PF4与肝素分子1∶1结合形成PF4-肝素复合物(PF4-H)后发生构象改变,刺激免疫细胞产生应答,释放抗PF4-H抗体(即HIT抗体),主要为IgG型。IgG型HIT抗体与PF4-H结合形成大分子复合物IgG-PF4-H,能大量结合在血小板表面特异性IgG抗体的受体(Fcγ RⅡa)上,引起血小板持续活化形成微血栓,并释放血小板微粒。同时,HIT抗体还可通过多种途径激活凝血途径,导致纤维蛋白血栓形成。此外,患者自身合并高凝状态等因素也是血栓形成的重要因素。HIT患者血小板计数降低的原因包括抗体结合的血小板被网状内皮系统吞噬以及在血栓形成过程中被消耗等。
临床表现
血小板减少
血小板计数减低是HIT患者最主要的临床表现,常见的变化特征是血小板计数下降至其基线值的50%以上,降低30%~50%的比例不到10%,且最低血小板计数一般≥20×10⁹/L。按照血小板计数下降的时间顺序可分为经典型HIT(60%)、速发型HIT(30%)和迟发型HIT(10%)。
血栓形成
未接受非肝素类药物替代抗凝治疗的HIT患者,血栓形成的风险很高(HITT 17%~55%)。HIT患者在静脉、动脉均可发生血栓,发生比例约为4∶1。常见的血栓形成部位及表现包括下肢深静脉血栓形成(DVT)、致死性肺栓塞、肾上腺静脉血栓形成等。
急性全身反应
少数患者在静脉注射肝素30分钟后出现急性全身反应,表现为肌肉僵直、寒战、发热、大汗、呼吸困难、心动过速或血压升高等,严重者可导致心脏、呼吸骤停。特殊情况下,可并发弥漫性血管内凝血(DIC),造成纤维蛋白原大量消耗和下降。此外,个别患者在使用肝素后发生全身性过敏反应,严重者可出现低血压和喉头水肿等临床表现。
出血
HIT导致的自发出血少见。
HIT的诊断
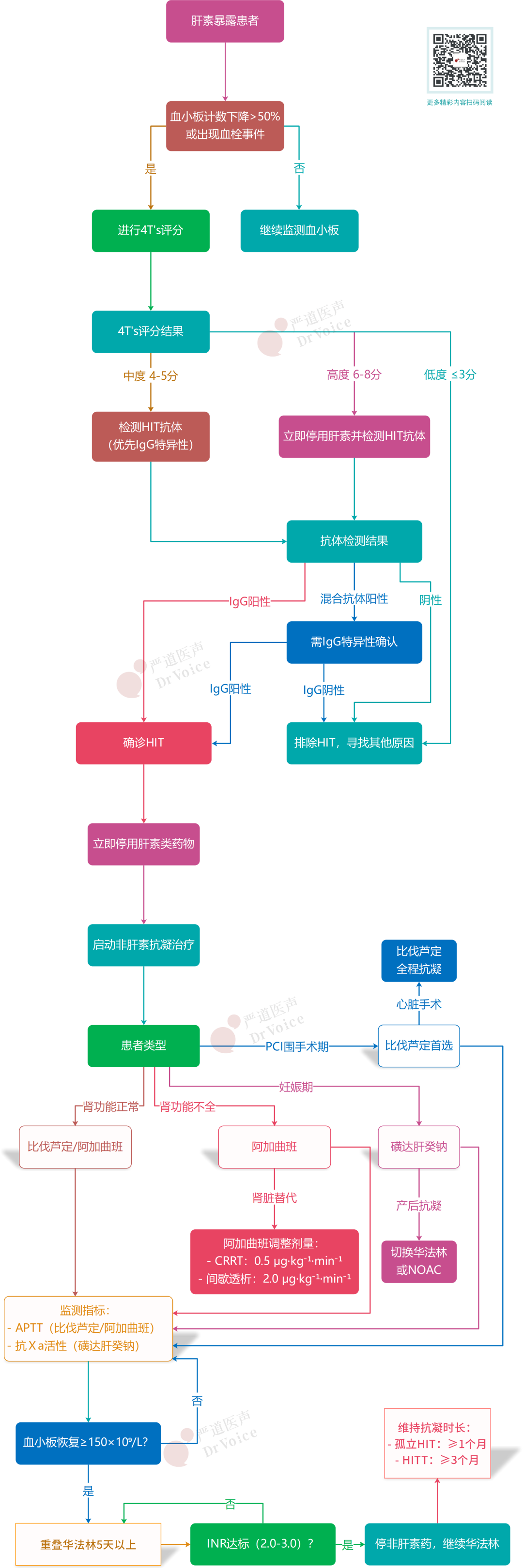
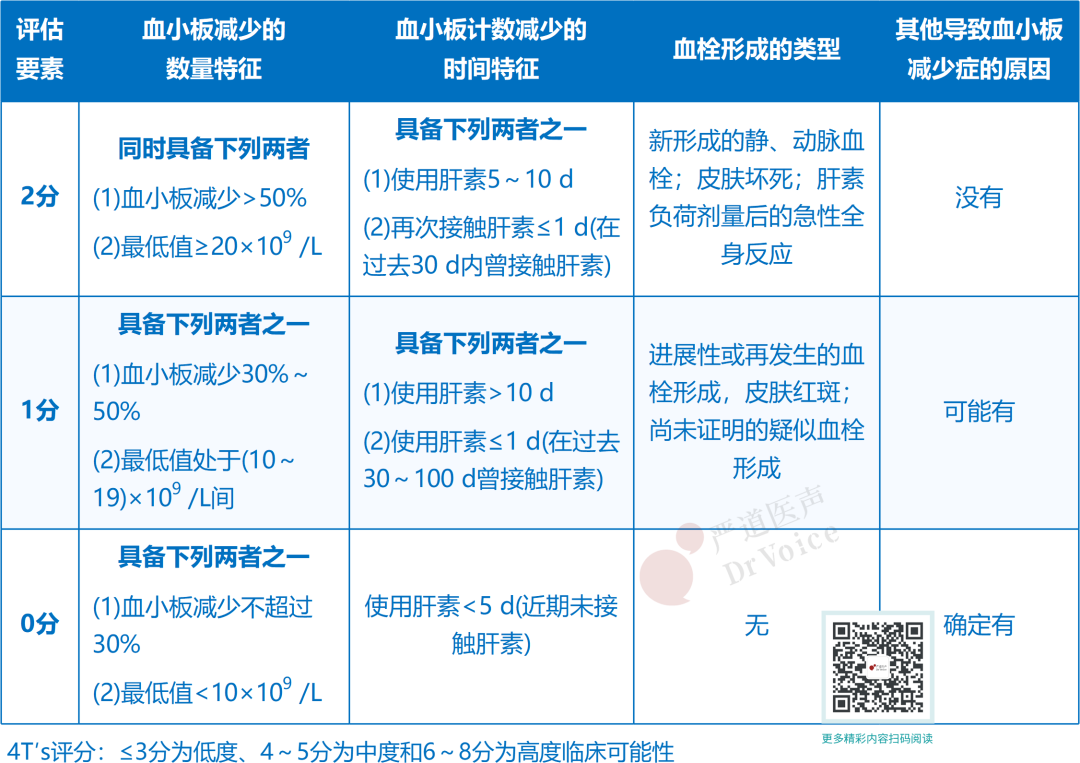
4T′s评分
4T′s评分由血小板减少的数量特征、血小板减少的时间特征、血栓形成类型,以及是否存在其他导致血小板减少的原因四个要素构成。根据得分多少确定HIT的临床可能性:≤3分为低度、4~5分为中度和6~8分为高度临床可能性。对于疑似HIT患者,首先使用4T′s评分进行临床危险度分层,为排除诊断和早期临床干预提供初步依据。但对于心脏外科手术患者评估不够准确,且应与抗体检测和血小板功能评价联合用于确定诊断。
实验室检查
主要包括血小板计数、血小板功能分析试验和HIT抗体检测。血小板计数减少是识别疑似HIT患者重要的标志事件。HIT抗体检测包括混合抗体(IgG、IgA、IgM)检测和IgG特异性抗体检测。HIT混合抗体诊断特异性较低,但敏感性较高,仅可用于排除诊断;IgG特异性抗体诊断的特异性高,在设定合理临界值的基础上,结合临床评估可实现诊断。对于4T′s评分为中、高度临床可能性患者,推荐检测HIT抗体,并持续监测血小板计数。
鉴别诊断
需与血栓性血小板减少性紫癜(TTP)、免疫性血小板减少性紫癜(ITP)、药物或感染等所致的血小板减少、多种混杂因素情况下的血小板减少以及EDTA诱导的血小板聚集等进行鉴别。
HIT的治疗
总体原则
HIT患者一经诊断或者高度怀疑应立即停用肝素,并接受非肝素类抗凝药物治疗,特别是HITT或存在继发血栓风险的患者。HIT治疗分为初始治疗阶段和维持治疗阶段。
初始治疗药物
主要包括比伐芦定、阿加曲班和磺达肝癸钠等胃肠外给药的药物。
高度疑似HIT:无需等待抗体结果,立即启动比伐芦定或阿加曲班;
PCI患者:比伐芦定单药抗凝优于肝素+GPⅡb/Ⅲa抑制剂(BRIGHT研究证据)。
维持治疗药物
多以华法林替代,华法林起效缓慢,至少需要3~5d才能起到抗凝作用。
时机:血小板≥150×10⁹/L或恢复基线,重叠使用≥5天;
目标INR:根据基础INR调整;
孤立HIT患者:建议应用非肝素类抗凝药物至少1个月,并且血小板数量恢复并稳定于基线水平;
HITT患者:建议抗凝治疗至少3个月。
特殊临床场景:从围术期到妊娠的个体化策略
经皮冠状动脉介入干预(PCI)
对于PCI术前发生急性HIT或亚急性HIT的患者,建议PCI术中使用比伐芦定或者阿加曲班,不可使用肝素或者LMWH。HIT患者PCI术后需要继续抗凝(孤立HIT1个月,HITT3个月)。
心脏及血管外科手术
心脏外科手术后患者更易产生HIT抗体。急性或者亚急性HIT患者行心脏或者血管外科手术时,推荐使用比伐芦定。有HIT病史,并且HIT抗体检测阳性的患者,行心脏或者血管外科手术时,推荐使用非肝素类抗凝药物如比伐芦定。
肾脏替代治疗
肾脏替代治疗(透析或者超滤)患者,如果透析前或在透析过程中发生急性HIT,或亚急性HIT患者,均推荐应用阿加曲班作为替代抗凝药物。连续肾脏替代治疗,建议阿加曲班100μg/kg静推,0.5μg·kg⁻¹·min⁻¹连续静脉输注,维持APTT于基线值的1.5~3.0倍;间歇肾脏替代治疗,建议阿加曲班250μg/kg静推,2.0μg·kg⁻¹·min⁻¹静脉注射,维持ACT在170~230s。比伐芦定也可用于肾透析患者。
妊娠期
妊娠期间需要继续抗凝的患者,往往使用LMWH替代华法林。妊娠期HIT的发生率明显低于非妊娠人群。妊娠时一旦发生HIT,应即刻停用肝素类药物,并应用非肝素类抗凝药物治疗。
妊娠期间使用的抗凝药物要求不能通过胎盘屏障,可审慎使用磺达肝癸钠。
既往HIT病史的患者抗凝药物选择
既往发生过HIT的患者再次暴露于肝素类药物时,发生HIT的风险高于无HIT病史者。根据既往的研究,NOAC(如利伐沙班)可以替代肝素类药物用于VTE的预防和治疗。
HIT伴出血
出血不是HIT的主要风险。HIT患者血小板计数很少低于20×10⁹/L,出血少见。
不建议常规预防性输注血小板,以避免潜在的血栓栓塞风险。
但如果发生严重出血或需行侵入性干预措施或大手术,仍可考虑输注血小板。
总结与展望
HIT是一种复杂的临床病症,其诊治需要综合考虑多种因素。从准确的诊断到合理的治疗方案制定,每一个环节都对患者的预后产生重要影响。通过深入理解HIT的病理生理机制、临床表现、诊断方法以及治疗策略,临床医生能够更好地应对这一挑战,为患者提供更为精准和有效的治疗。
HIT的诊治核心在于“早期识别、快速停药、合理替代”。4T's评分与IgG抗体检测的联合应用可提高诊断准确性,而非肝素抗凝药物的规范化使用是改善预后的关键。临床实践中需结合患者个体情况,在血栓与出血风险间精准平衡,方能降低HIT相关不良事件。