
文章标题:《新型双螺旋固定式心房无导线起搏器的临床前安全性表现和电学性能表现》
发表时间:发表于2022年5月《Heart Rhythm》杂志。
研究背景及目的
• 每年全球植入超过100万台心脏起搏器和除颤器,然而在植入后的前6个月内,仍有大约10%-15%的患者会出现相关并发症,这些并发症主要与导线和囊袋相关,包括导线脱位、断裂、三尖瓣返流、袋囊感染、血肿和气胸等,为了减少这些并发症,无导线起搏器应运而生;
• 最初的无导线起搏器研究和开发主要集中在右心室(RV)无导线起搏器上,但因为单个RV机器无法提供真正的DDD(R)或AAI(R)起搏,因此无导线的适用人群相对受限;
• 然而,随后无导线起搏器的外形和固定机制方面得到了改善,为右心房(RA)植入的发展打开了大门,随之即出现了RA无导线起搏器;
• 本研究通过为期12周的临床前绵羊试验评估了新型双螺旋固定式心房无导线起搏器 AR的安全性和相关性能表现,包括植入成功率、电学性能、机械稳定性和安全性表现;此外,本研究采用了台式研究(Benchtop Study)用于量化无导线起搏器牵拉脱位所需的机械力,并与传统经静脉导线进行对比。
研究方法
设备简介
• AVEIR™ AR心房无导线起搏器具有双螺旋固定机制,以增强长期电学稳定性和机械稳定性(图1);
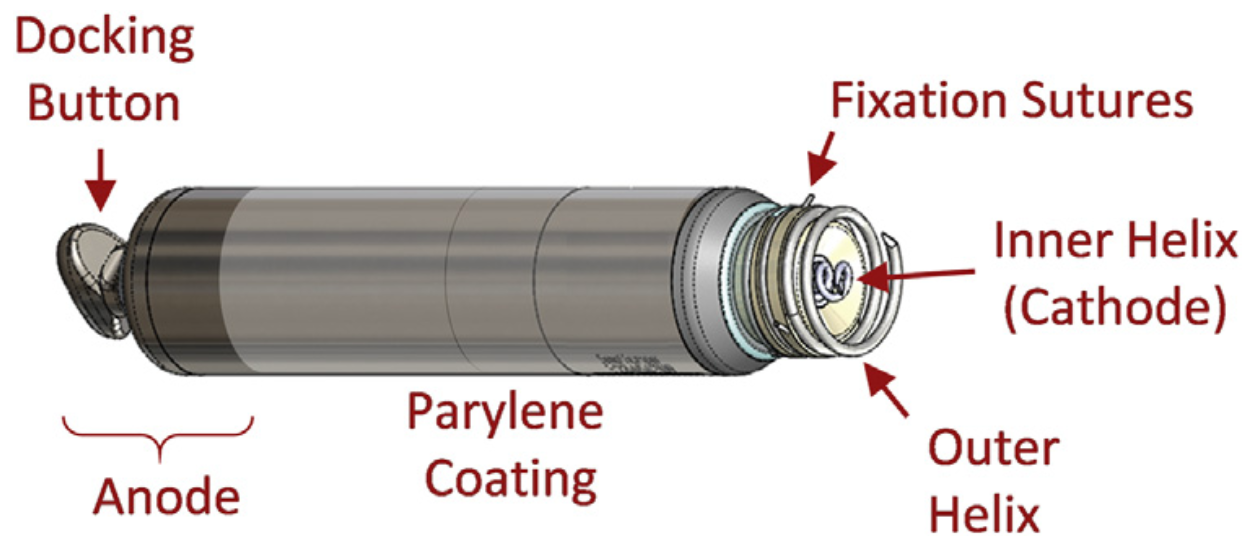
图1 Aveir AR心房无导线起搏器示意图
• 外螺旋的旋入深度约为1.6mm,小于大部分经静脉导线(通常为1.8-2.0mm);其不具有电活性,仅提供机械固定,其螺旋尖端向远离心肌的方向变尖,以尽量避免心房壁穿孔发生,从而避免心包积液等并发症发生;
• 内螺旋略微低于外螺旋,其具有电活性,作为无导线起搏器的阴极;内螺旋的螺旋尖端像经静脉导线一样向靠近心肌方向变尖,以促进心肌组织穿透;
• AVEIR™ AR心房无导线起搏器的其他部件功能与AVEIR™ VR类似,包括尾端的对接钮用于配合对接和回收、螺旋周围的3个二级固定线用于防止逆旋、机器拥有装载工具用于术中装载对接、同样的专用回收导管用于高效安全地远期取出、传导通信方式与程控仪达到信息交互等。
研究设计
•研究对象为10只萨福克杂交雄性绵羊,在每只绵羊的右心耳植入Aveir心房无导线起搏器,任何与静脉通路、器械植入和受试者恢复相关的并发症均会被记录;
•在植入时记录起搏阈值(0.4ms脉宽)、感知振幅和起搏阻抗,并在植入后第0.5、1、2、3、4、5、9和12周再次测试记录;植入时的参数是在无导线起搏器释放后立即测试记录的,此时受试者侧卧且处于麻醉状态;植入后的参数是在动物站立且清醒时测试记录的;通过统计学模型分析结果,P<0.05被认为具有显著性;
•经过12周的电学参数测试后,对受试绵羊实施安乐死,并进行大体病理学和组织学病理学分析;通过辨别记录所有不良事件来评估设备安全性,例如机器脱位、心房壁穿孔、心包积液、心包填塞、感染和瓣膜返流。
植入流程
•每只绵羊在植入时均被麻醉,于股静脉内通过AVEIR™ 27F传送鞘管,在透视影像指导下,将无导线起搏器送至右心耳的前内侧区域;
•在旋入前进行Mapping标测,测试阈值、感知和阻抗,当参数处于可接受范围(阈值≤3.0V,感知≥1.0mV)时,使用输送导管将无导线起搏器旋入1.5圈,使内外螺旋均充分旋入接触心肌;
•之后,将机器进入对接栓模式,通过透视影像确认植入稳定性,并再次测量阈值、感知和阻抗;在确认参数满意、植入位置合适后,释放无导线起搏器,移除导管;最后再次测试阈值、感知和阻抗,并记录腔内电图和其损伤电流。
大体病理学和组织病理学
• 在12周后,对受试绵羊的心脏进行大体病理学检查:检查是否有心外膜表面、心内膜表面、心包表面和三尖瓣相关的损伤迹象;记录所有穿孔、心包液变色、心包与心外膜的粘连以及螺旋是否从心外膜表面可见的事件;对植入无导线起搏器的心外膜区域和心内膜区域进行拍照记录;
• 对一部分心脏进行生理盐水冲洗和甲醛处理以进行组织病理学检查:进行H&E染色和MET染色,并由一位独立的、经委员会认证的兽医病理学专家评估心肌组织对植入物的反应。
台式力度测量
• 将RA无导线起搏器和主动固定经静脉导线(Tendril 2088,Abbott)植入离体猪心耳组织内进行体外力度测量,分别测量使无导线起搏器和主动导线脱位所需的拉力(即张力),以及旋出无导线起搏器和主动导线以远期取出所需的旋转力(即扭力);
• 为了头对头比较,通过将扭力除以无导线起搏器或主动导线螺旋的外圈半径(即扭力臂),会将扭力换算成线性力;使用未配对t检验评估力度差异,P<0.05被认为具有显著性。
研究结果
植入安全性
•在所有10只绵羊中,均通过一次旋入即于右心房内成功植入RA无导线起搏器;其中,无起搏器重新定位事件,无任何术中与术后并发症发生;
•植入时绵羊体重正常(82.2±4.8kg;范围75.0-91.0kg)。
电学性能表现
•在无导线起搏器释放前,所有起搏阈值(0.4ms脉宽)均小于3.0V;植入前和植入后的腔内电图中损伤电流改变证明螺旋与心肌的充分咬合(图2);
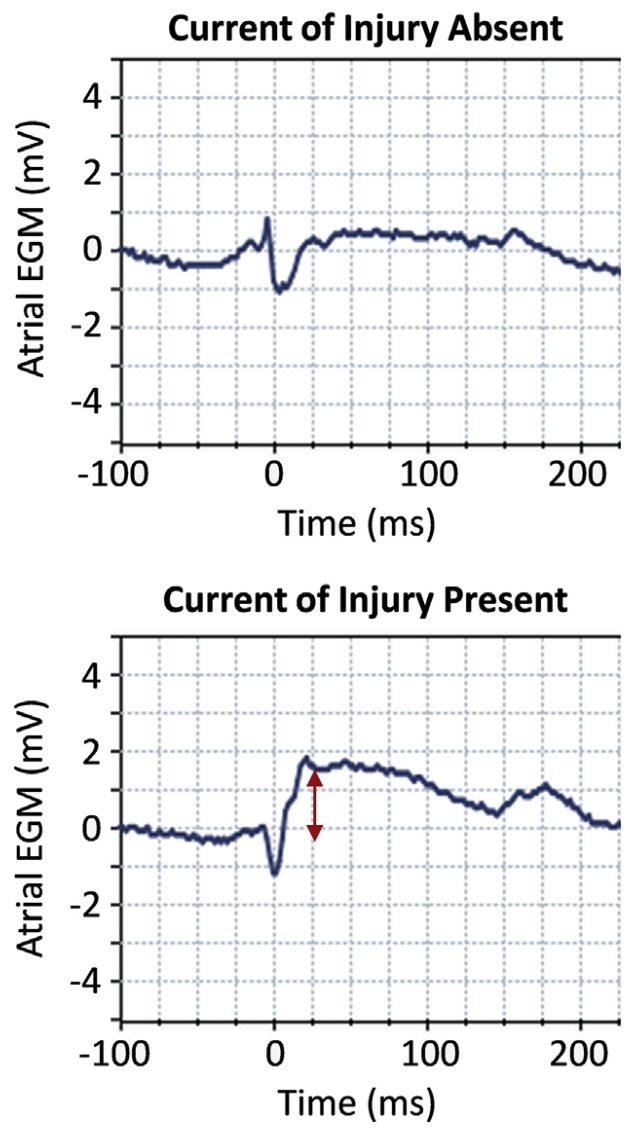
图2 植入前和植入后腔内电图中损伤电流的改变
•在植入时的起搏阈值为1.1±0.7V,在第4周时显著改善至0.6±0.3V(P=0.031),并在第12周时进一步降低至0.4±0.2V(P=0.008)(图3);
•在所有测试节点,感知振幅均大于1.0mV,植入时的感知振幅在第12周呈上升趋势,但无统计学意义(4.8±1.8mV vs 6.0±1.9mV,P=0.160)(图3);
•起搏阻抗从植入到第12周保持稳定(393±77Ω vs 398±65Ω,P=0.922)(图3)。
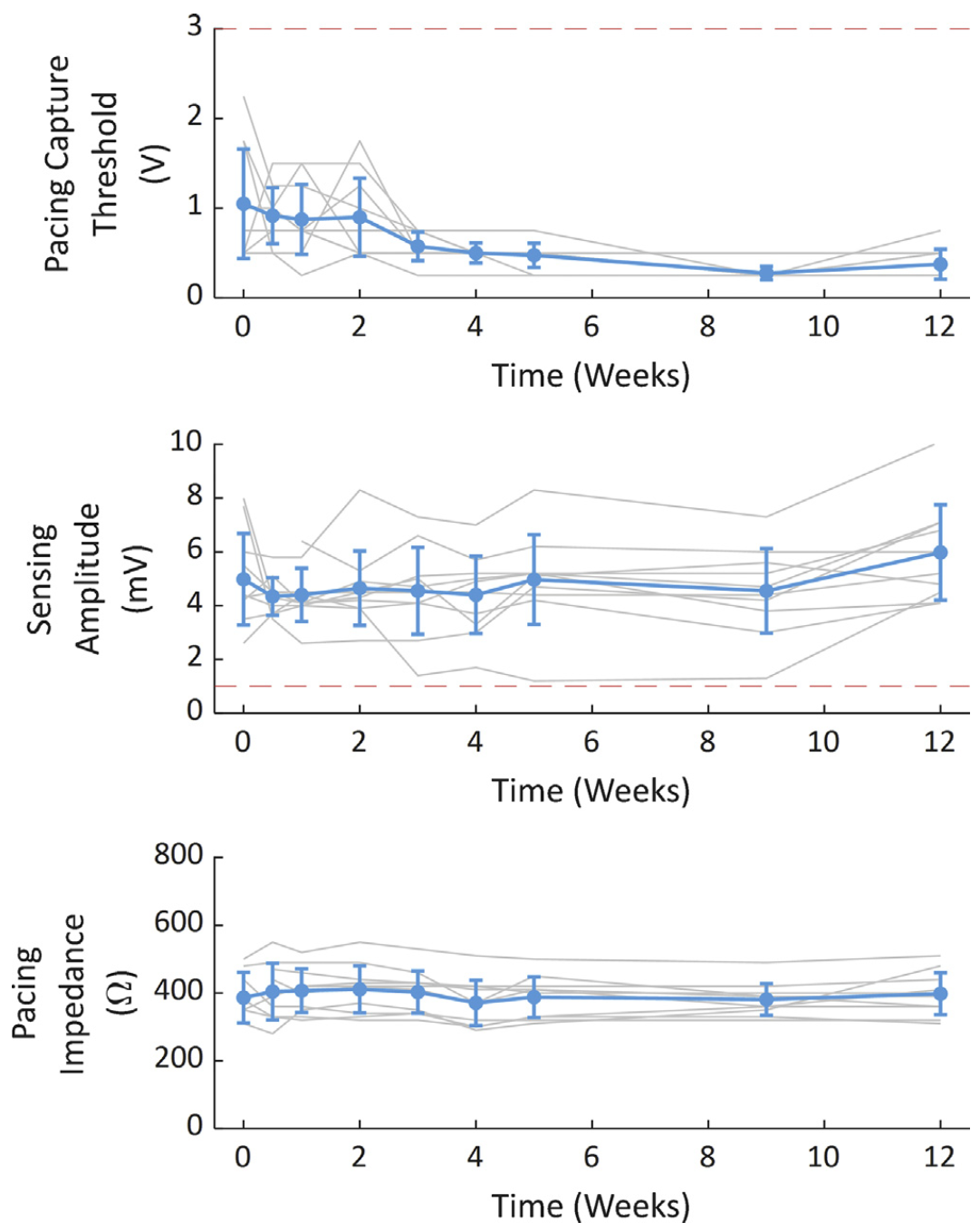
图3 从植入时至第12周的电学参数结果
大体病理学和组织病理学
•在大体病理学层面,所有器械均安全地植入在右心耳中,无脱位情况发生;图4A分别显示了从心外膜表面和心内膜表面观察到的植入示例的图片;
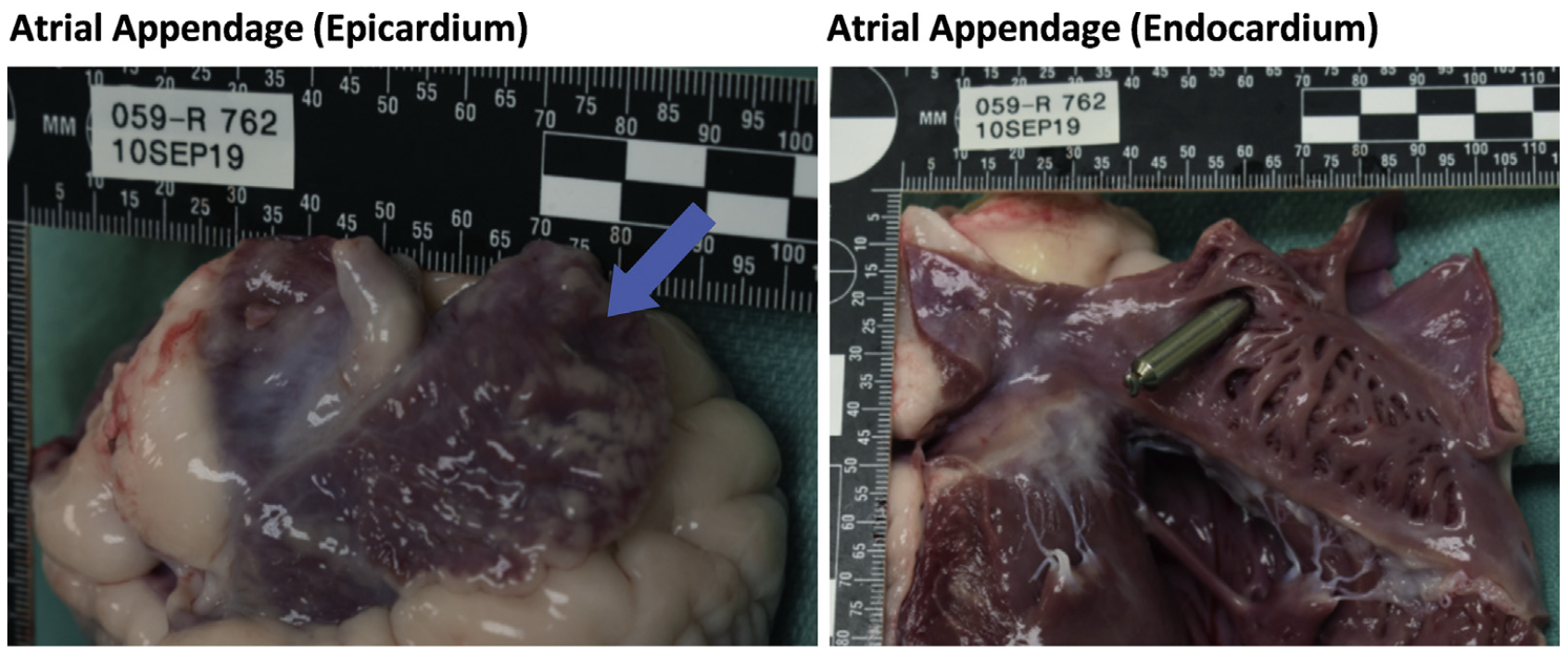
图4A 从心外膜和心内膜表面观察的植入示例图
•在本研究中植入的无导线器械均未发生任何感染事件、心外膜与心包粘连事件以及有临床影响的螺旋尖端穿入心包内的穿孔事件;尽管偶尔在心外膜侧能观察到局部螺旋,但未发生覆盖植入部位的心包局部增厚情况,也未在心包内观察到血液,且所有心包积液水平均在正常范围内,因此,本研究认为该情况是无临床影响的;
•无心房重塑、水肿、扩张或肥大事件发生;无房间隔缺损发生;无三尖瓣瓣叶损伤、撕裂或增厚情况发生,且无机器与腱索缠绕情况发生;
•对心房心肌的横截面进行大体病理学检查,未发现梗死、感染、出血、水肿或纤维化的情况;所有受试绵羊的心房游离壁和间隔在与无导线起搏器接触处均可见轻度心内膜纤维化,但均在正常预期范围内;
•在3只接受微观组织病理学分析的受试绵羊中,病理学专家未发现任何临床上显著的改变;图4B分别显示了植入部位的H&E和MET染色横截面示例,观察到的纤维反应在正常预期范围内(因有长期植入器械);病理学家还观察到轻微的心脏组织重塑,伴有骨质钙化,这与之前的绵羊试验中现象类似,在人类中不会发生。
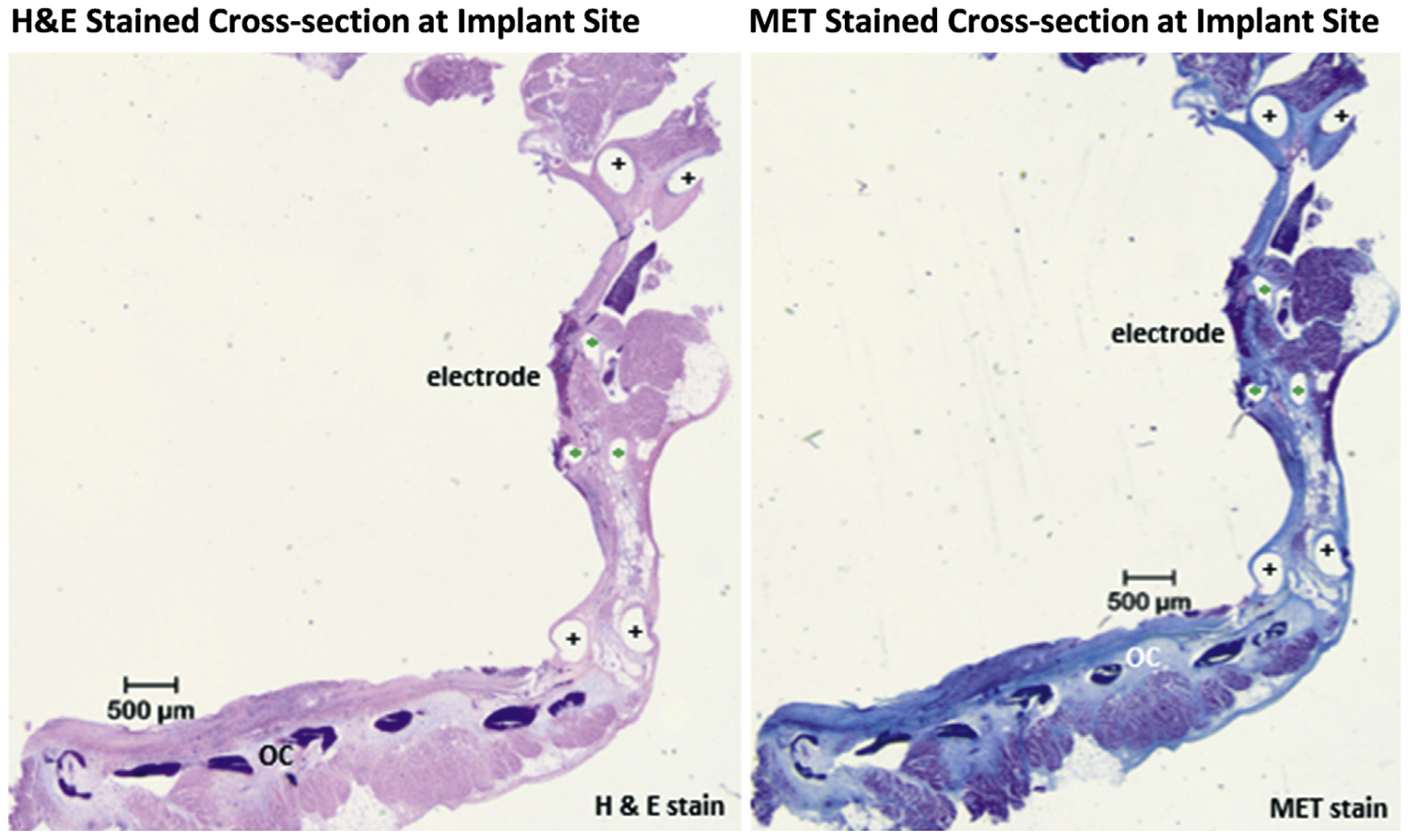
图4B 组织病理学染色横截面示例
与经静脉导线的力度比较
•在离体猪心耳组织中植入的18个无导线起搏器和15根经静脉导线中分别测量了使无导线起搏器和主动导线脱位所需的拉力:使无导线起搏器脱位所需的拉力显著大于经静脉导线(0.42±0.18lbf vs 0.29±0.08lbf,P=0.020)(图5);
•在离体猪心耳组织中植入的22个无导线起搏器和30根经静脉导线中分别测量了旋出无导线起搏器和主动导线所需的旋转力:旋出无导线起搏器所需的旋转力也显著大于经静脉导线(0.28±0.04lbf vs 0.14±0.07lbf,P<0.001)(图5)。
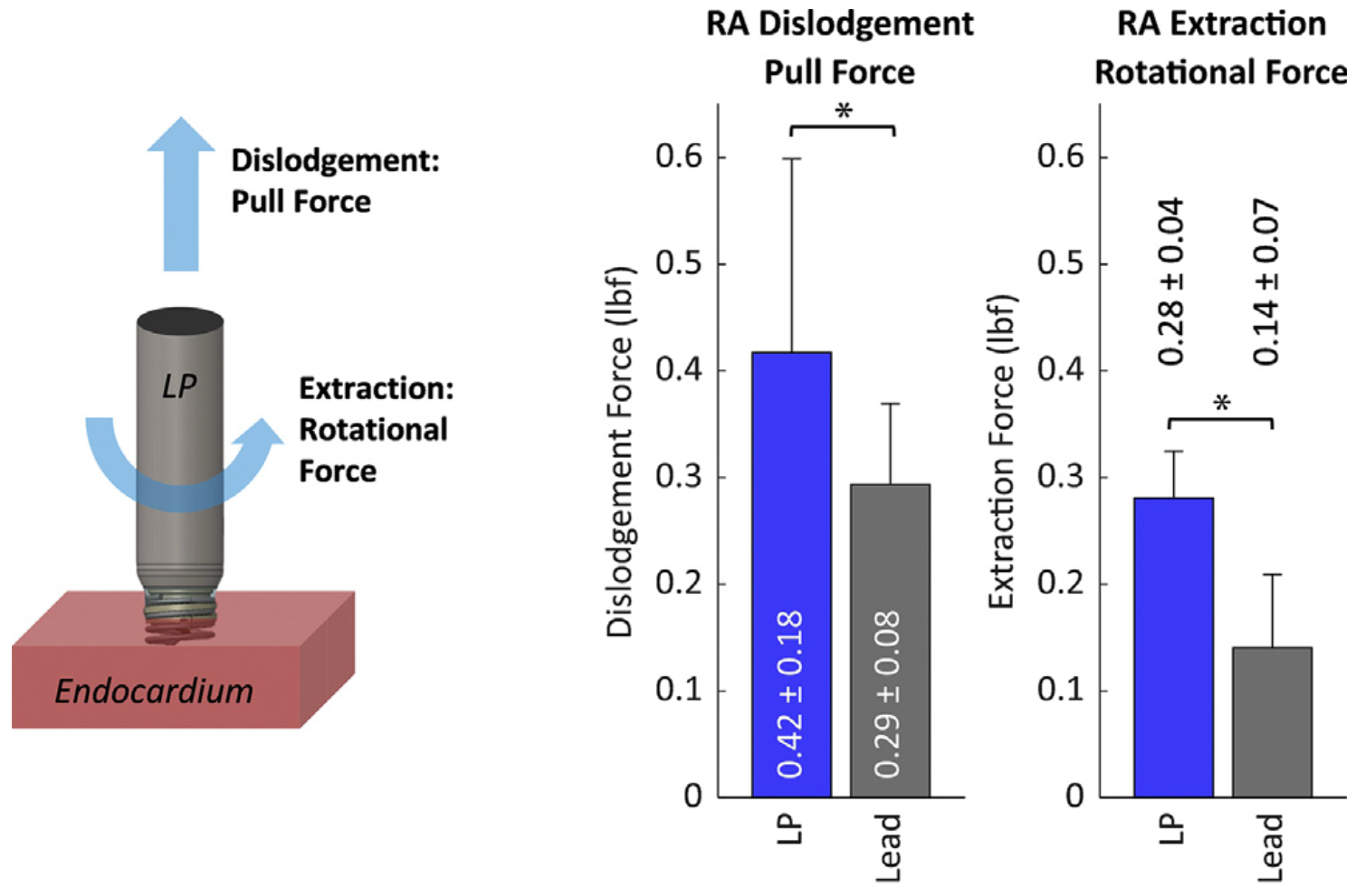
图5 无导线起搏器与经静脉导线脱位和旋出所需力度对比
研究小结
•本研究通过10只绵羊的临床前试验,证明了新型双螺旋固定式心房无导线起搏器AVEIR™ AR在各方面的优异表现:
•术中无需重新定位,通过Mapping标测确保一次旋入即可成功植入,同时也无任何术中并发症发生;
•术后长达12周的出色电学性能表现,起搏阈值、感知振幅和起搏阻抗等参数均表现良好且稳定;
•术后长达12周无任何并发症发生,且无任何脱位情况发生;
•台式力度测量也证明了其机械稳定性良好,且显著优于传统经静脉主动固定导线;
•心房无导线起搏器AVEIR™ AR的临床应用将显著扩大无导线起搏器的目标患者人群,使更多患者能够受益于无导线起搏疗法的独特优势。
参考文献:
Rashtian, Mayer, et al. "Preclinical safety and electrical performance of novel atrial leadless pacemaker with dual-helix fixation." Heart Rhythm 19.5 (2022): 776-781.