健心知著
2025.07.11
第488期

冠状动脉计算机断层扫描血管造影中观察到的阻塞性冠状动脉疾病的临床可能性模型

刘健、柏庚、苏晓凤
北京大学人民医院
健心荐语
对于新发稳定胸痛患者,准确评估阻塞性冠状动脉疾病(CAD)的临床可能性对诊疗决策至关重要。传统预测试概率(PTP)模型基于混合有创冠状动脉造影(ICA)和冠状动脉CT血管造影(CCTA)数据,可能低估CCTA检测的狭窄程度。本研究提出了一种基于CCTA校准的新型临床可能性模型(RF-CLCCTA和CACS-CLCCTA),通过整合风险因素(RF)和冠状动脉钙化评分(CACS),显著提高了阻塞性CAD的预测准确性,为临床决策提供了更可靠的依据。
文章介绍
本研究由欧洲心脏病学会(ESC)发表于《European Heart Journal - Cardiovascular Imaging》(2025年1月),旨在开发和验证两种CCTA校准的临床可能性模型,用于预测稳定胸痛患者的阻塞性CAD。研究通过大规模多中心队列验证,证实了新模型在风险分层中的优越性。
研究方法
研究分为训练队列(n=38269)和验证队列(n=28340),纳入标准为疑似CAD的新发胸痛患者,排除已知CAD病例。通过机器学习算法,开发了基于CCTA校准的RF-CLCCTA和CACS-CLCCTA模型,用于在无已知CAD史的训练队列中预测CCTA检出的阻塞性CAD患病率:
RF-CLCCTA模型:基于年龄、性别、症状典型性和心血管风险因素(高血压、血脂异常、糖尿病、吸烟、早发CAD家族史)。
CACS-CLCCTA模型:在RF-CLCCTA基础上增加CACS数据。
主要终点为CCTA检测的阻塞性CAD(定义为直径狭窄>50%),并与传统Basic PTP模型进行比较。
研究结果
训练队列(n = 38269)用于模型开发和截断值推导;验证队列(n = 28340)用于模型和截断值验证。表1展示了训练队列与验证队列的基线特征及诊断检测结果。在训练队列中,8068例(21.1%)患者经CCTA检出阻塞性CAD。该队列中CCTA检出的阻塞性CAD实际患病率显著高于基础PTP模型的预测平均概率(13.7%,P < 0.001)。男性、年龄增长、危险因素数量增加以及冠状动脉钙化积分(CACS)升高与CCTA检出的阻塞性CAD患病率呈正相关。
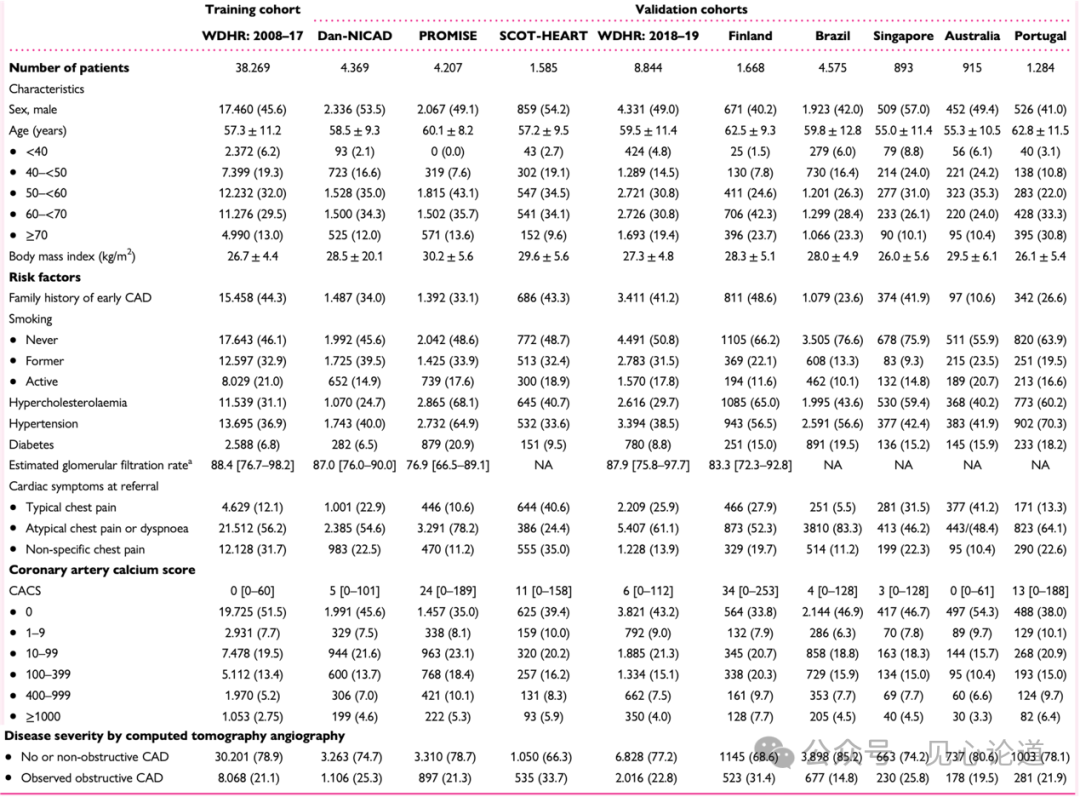
表1:患者人口统计学和CCTA结果
基于逻辑回归分析开发的RF-CLCCTA模型纳入了危险因素分类、性别、年龄和症状典型性等参数,而CACS-CLCCTA模型则在临床可能性评估中额外整合了CACS指标(图1)。基础PTP、RF-CLCCTA和CACS-CLCCTA三种模型均显示,随着临床可能性评分升高,CCTA检出的阻塞性CAD患病率递增。
训练队列中3057例(8.0%)患者经侵入性冠状动脉造影(ICA)确诊阻塞性CAD。研究确定了超低临床可能性组(RF-CLCCTA和CACS-CLCCTA评分<5%),该组ICA确诊阻塞性CAD患病率<1%(图2)。当RF-CLCCTA和CACS-CLCCTA截断值分别设为<17%、<35%和<82%时,ICA确诊阻塞性CAD的患病率相应低于5%、15%和50%。
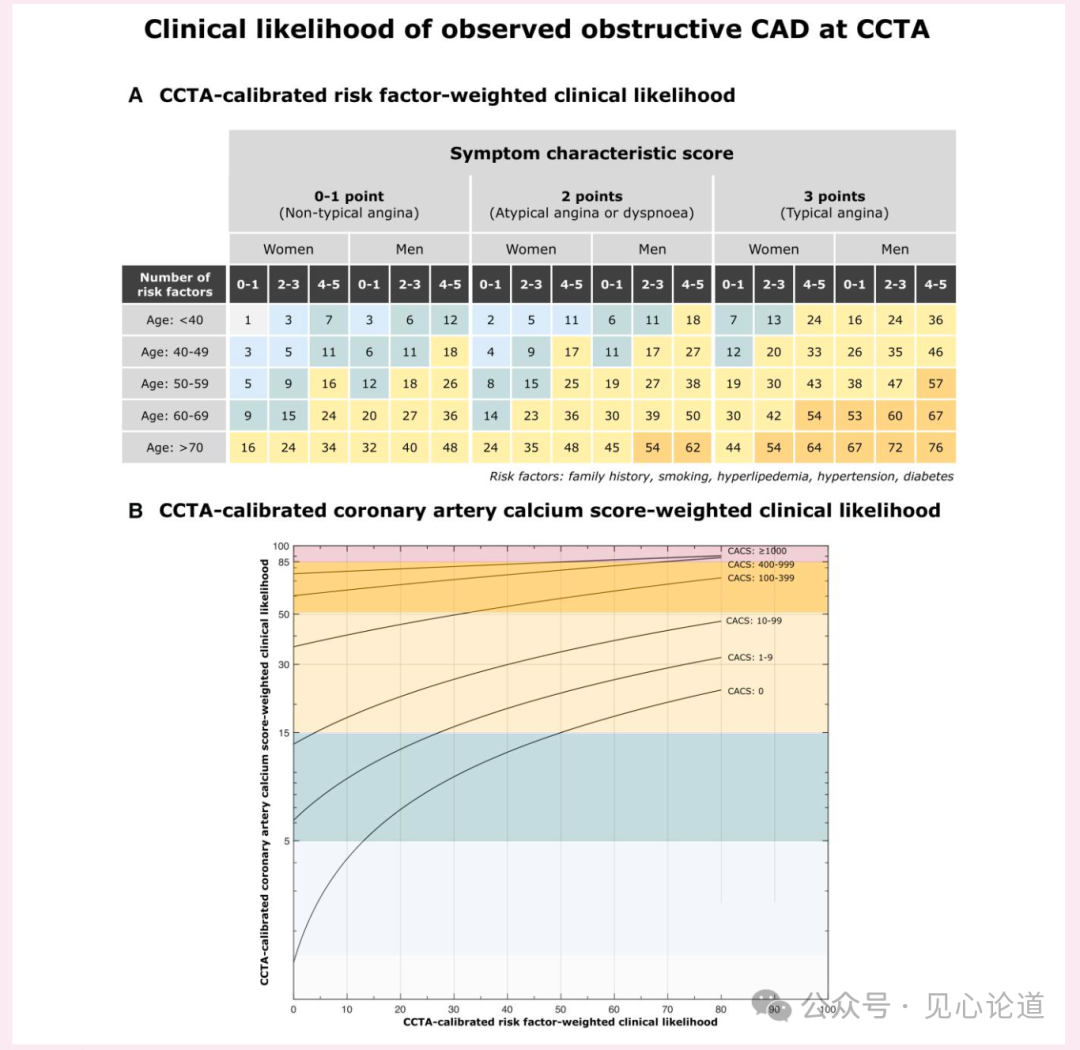
图1:基于危险因素和冠状动脉钙化积分加权的临床可能性模型(以CCTA观察到的阻塞性CAD为校准标准)。A部分展示按年龄、危险因素数量、性别和症状典型性分层的观察到的阻塞性CAD患病率;B部分展示按钙化积分分组进一步分层的观察到的阻塞性CAD患病率。结果来自训练队列(n=38269)。根据A+B所示的临床可能性评估,ICA诊断的阻塞性CAD患病率见图2。
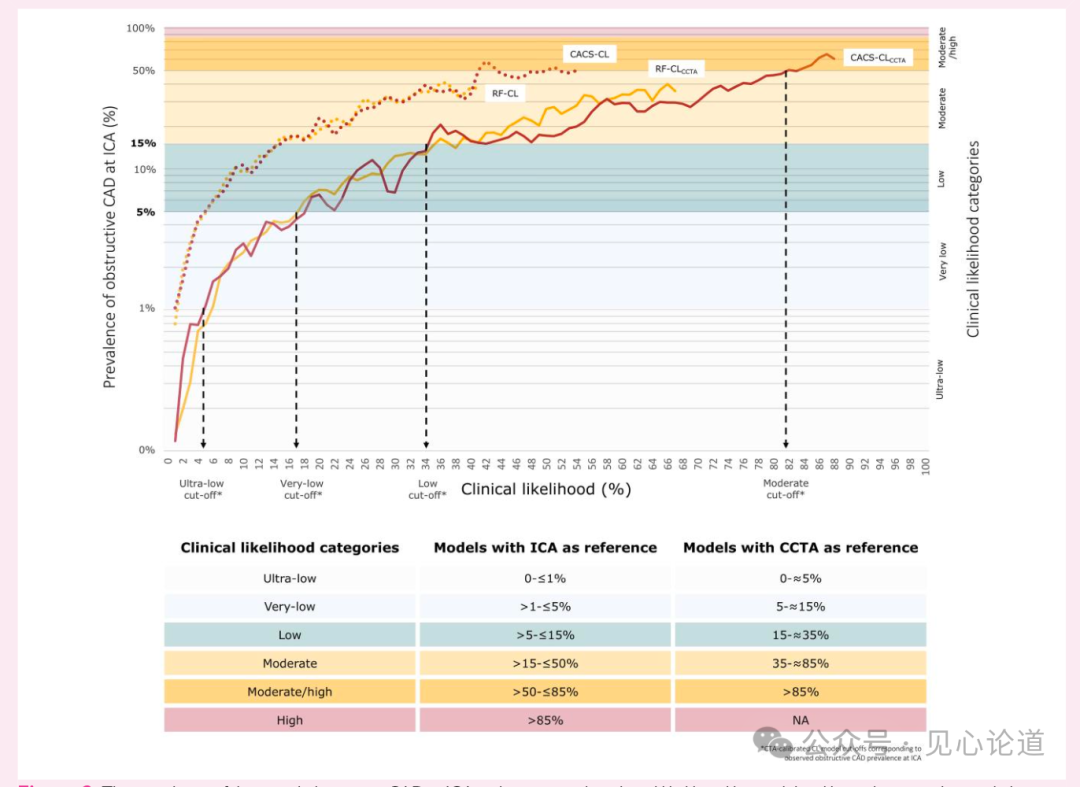
表2:在训练队列(n=38269)中,经CCTA观察到的阻塞性CAD(实线)和ICA诊断的阻塞性CAD(虚线)校准后,ICA诊断的阻塞性CAD患病率及相应模型的临床可能性。箭头表示基于冠状动脉CT观察到的阻塞性CAD校准的临床可能性模型临界值,及对应的ICA诊断阻塞性CAD患病率。
在汇总验证队列中,6443例(22.7%)患者经CCTA检出阻塞性CAD。基础PTP模型低估了CCTA检出阻塞性CAD的患病率,而RF-CLCCTA和CACS-CLCCTA模型展现出良好至优异的校准度。以CCTA检出阻塞性CAD为参照标准时,RF-CLCCTA和CACS-CLCCTA模型具有更优的判别能力,其中CACS-CLCCTA模型的总体判别效能最高。这一结果在构成汇总验证队列的各独立队列中具有一致性,仅因CCTA检出阻塞性CAD患病率的差异存在轻微波动(图3)。
当采用5%作为预测CCTA检出阻塞性CAD的截断值时,基础PTP、RF-CLCCTA和CACS-CLCCTA模型虽保持高灵敏度(96%-99%),但特异性较低(6%-24%)(表2)。当截断值提升至15%时,RF-CLCCTA和CACS-CLCCTA模型仍维持高灵敏度(89%-93%),而基础PTP模型的灵敏度显著下降至68%。与5%截断值相比,所有模型在15%截断值下的特异性均有所提升。
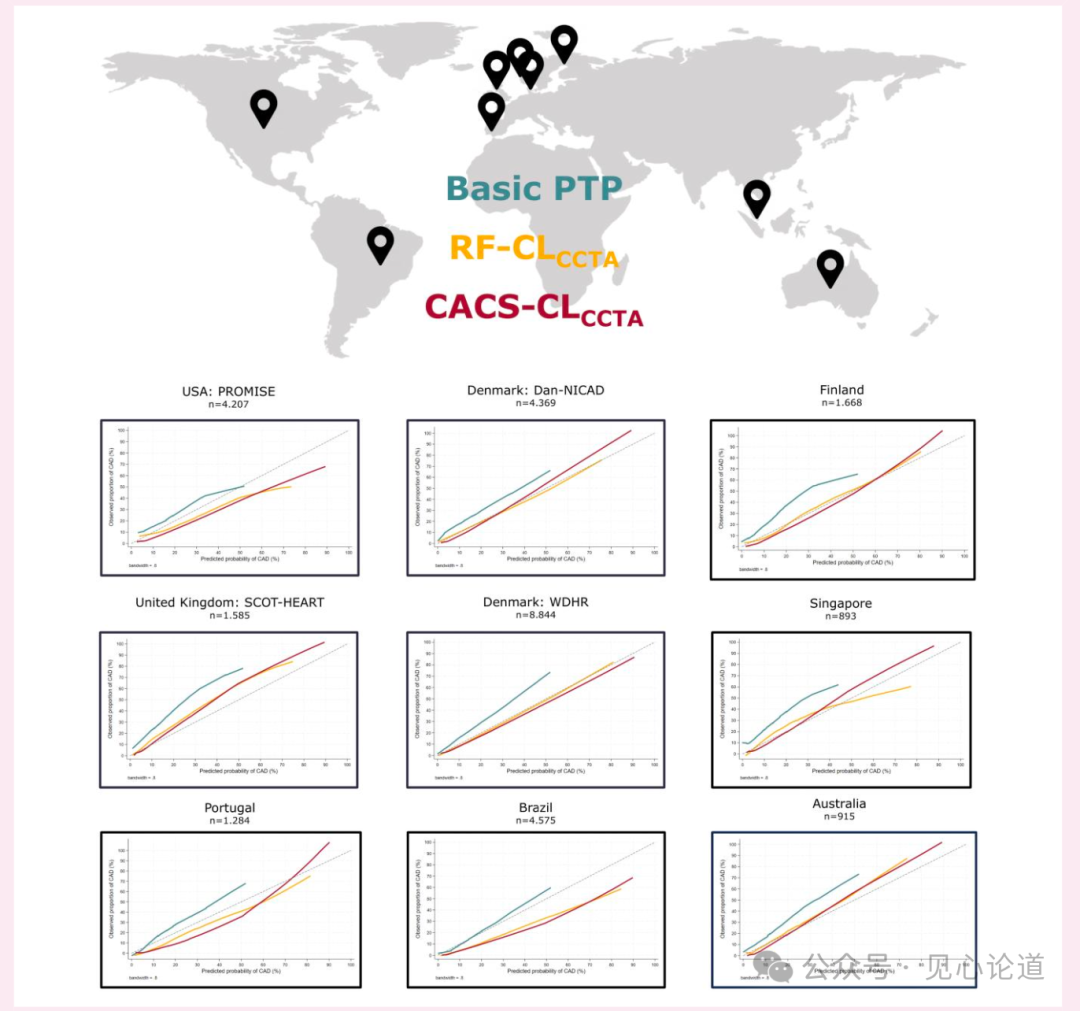
图3:针对通过CCTA观察到的阻塞性CAD(按验证队列分层),对Basic PTP、RF-CLCCTA和CACS-CLCCTA模型进行校准。WDHR队列代表对2018至2019年纳入队列的时间验证
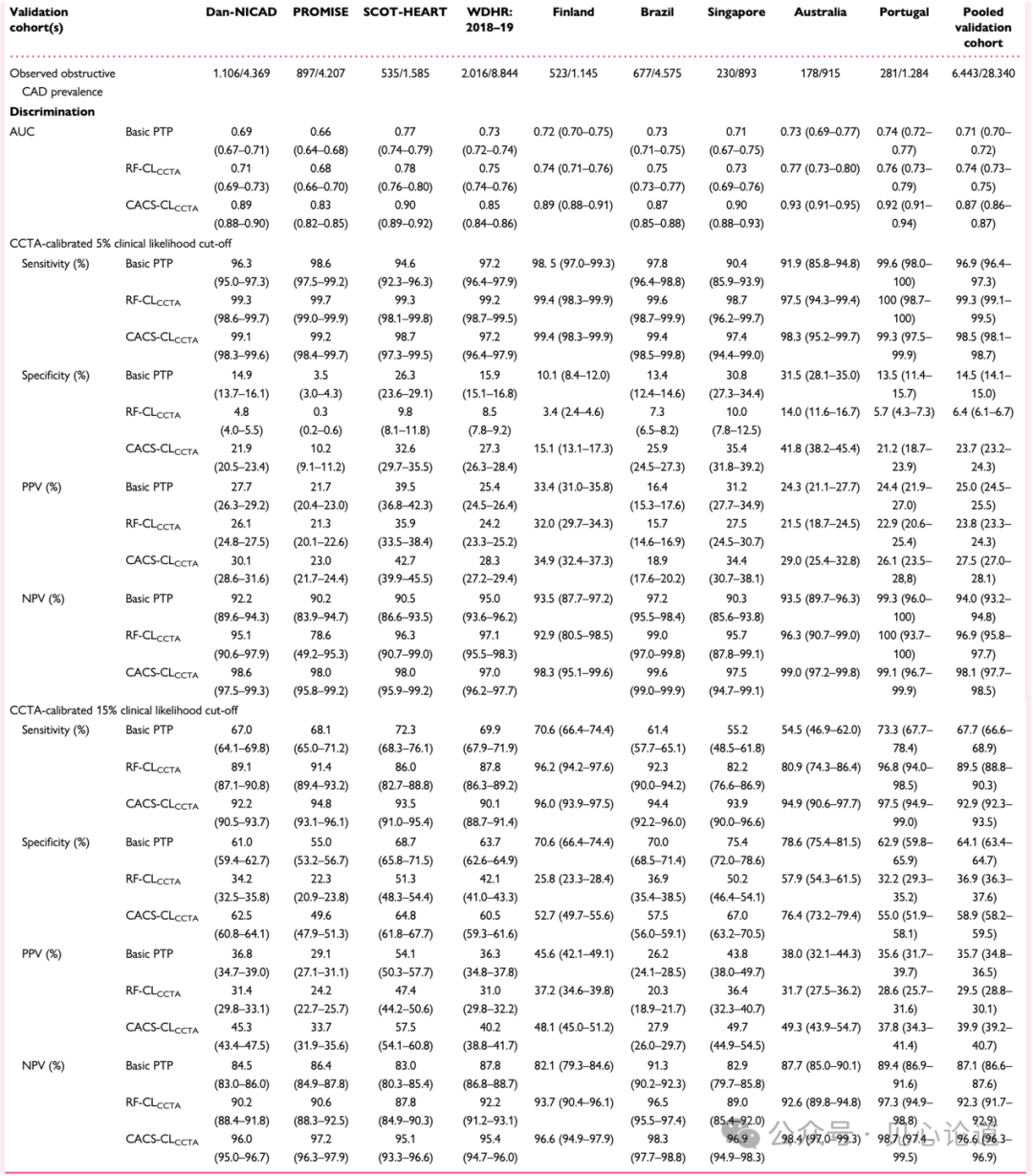
表2:在验证队列中,基本PTP、RF-CLCCTA和CACS-CLCCTA模型对CCTA观察到的阻塞性CAD的诊断性能
结 论
新型基于CCTA校准的风险因素和冠状动脉钙化评分加权的临床可能性模型,可提升CCTA检查中观察到阻塞性CAD的校准度和鉴别能力。
讨论
该研究通过开发基于CCTA校准的新型临床可能性模型(RF-CLCCTA和CACS-CLCCTA),显著提升了阻塞性CAD的诊断准确性。研究创新性地采用多中心大样本验证(训练队列38269例,验证队列28340例),证明新模型相比传统PTP模型具有更优的校准度和判别力(AUC 0.87)。其核心价值在于:①确立超低风险分层标准(ICA确诊率<1%),使6.7%患者可安全避免侵入性检查;②提出与ICA结果对应的临床决策阈值(如RF-CLCCTA<17%对应ICA患病率<5%),为指南推荐的非侵入诊断路径提供量化依据。但研究存在选择偏倚(仅纳入CCTA检查患者)和预后数据缺失等局限,未来需结合长期随访验证临床效益。