
纳秒(nanosecond,符号为ns)=0.000 000 001 秒=10⁻⁹ 秒
第一章:原始时代
直流电击“放电疗法”:心脏上的电刑
在20世纪80年代,医生们就尝试将导管送入心脏腔室,通过直接释放直流电脉冲来治疗心动过速。电击后,患者虽然转复窦性心律,却如同遭受“全身电刑”——骨骼肌强烈收缩(强制性收缩)、组织爆裂性坏死、心肌穿孔风险高达15-30%……。德国汉堡的国际知名电生理专家欧阳非凡教授曾说,那时候,医生用电击治疗心动过速后,患者心律转复窦性心律,当时医生意外发现电击后冠状窦电极的心房电位显著降低,后来回想才明白那是脉冲电场对冠状窦周围心房组织健康心肌细胞的损伤效果,这体现了最早期脉冲电场的双刃剑效应:一方面精准摧毁病灶,另一方面也损伤了健康的心肌。
这种“震荡疗法”因患者无法耐受、术者操作风险过大,迅速被90年代出现的射频消融技术取代,却也因为偶然发现PFA的生物学效应而埋下了PFA技术的种子。
第二章:热疗时代
高能量直流毫秒脉冲被热疗取代
1982年这项技术的致命伤,藏在“毫秒级脉宽”的物理特性中。
对患者而言,300-400焦耳的高能量直流脉冲电流在5-10毫秒内瞬间释放,强大的直流电场直接击穿细胞膜,造成细胞凋亡,达到毁损靶细胞治疗心律失常的效果;但与此同时,电流同步刺激胸壁肌肉和膈神经,如同在心脏和身体上施加电刑,会有十分剧烈的不适感,触发全身骨骼肌剧烈的强直性收缩。
上述毫秒脉宽的直流电脉冲因靶点失焦,造成三大“灾难”:
一是组织损伤野蛮:电弧导致组织气化、爆裂性坏死,消融部位形成巨大焦痂,周围血管神经难以幸免。
二是定位精度为零:电流在心脏内“四处溅射”,医生无法聚焦特定病灶,每次放电如同“开盲盒”。
三是患者体验噩梦:长时程单相毫秒级直流脉冲触发全身肌肉强直收缩,术中需施加全身麻醉和肌松剂组合拳。
“就像被重锤击中胸口,全身肌肉不受控制地抽紧,术后胸口灼痛持续数周。”一位80年代接受该治疗的患者回忆。
鉴于毫秒级的脉冲直流电场消融的副作用远大于患者的获益, 随后的几年间,直流方波电脉冲输出的PFA技术被正弦波交流电输出的射频消融技术完全替代,但利用直流PFA治疗心律失常的核心理念,如同一粒休眠的种子,等待生物物理学的阳光再次唤醒。
第三章:颠覆革命
纳秒脉冲电场消融技术登场
破解脉冲宽度奥秘,找到让脉冲电场技术扬长避短的钥匙
脉冲电场的优势和劣势并存。
其优势在于,脉冲电场消融具有很强的组织选择性,这意味着它更安全,能选择性地损伤心肌细胞,而避免损伤膈神经、食道,从而有效避免冷冻和射频热消融对心肌毗邻组织的损伤及其带来的膈神经损伤、心房食道瘘以及肺静脉狭窄等严重的并发症;此外,脉冲电场更高效,仅通过数秒的“放电”消融,就能实现传统射频需要1-2个小时逐点消融才能达到的肺静脉隔离效果。
综上,安全、高效,这几乎是术者在所有治疗类手术中梦寐以求的。
如何发挥其优势,避免其副作用?科学家们发现,关键点在于脉冲宽度。
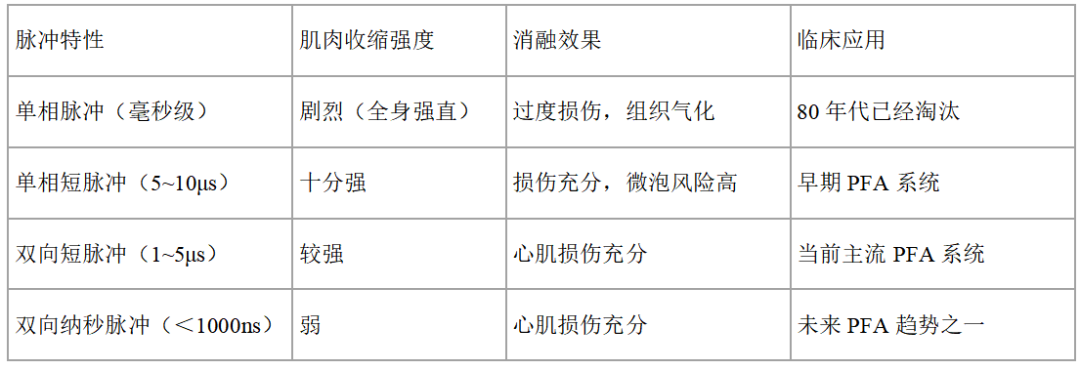
脉冲宽度是腔内直流脉冲电场消融造成患者全身骨骼肌强直性收缩的关键因素,其作用原理为具有神经兴奋阈值、脉冲宽度超标、电流扩散失控,这意味着其触发神经动作电位需持续刺激至少0.1ms(100μs),而早期直流消融采用毫秒级单相脉冲(通常5-10ms),远超神经兴奋阈值,长时程放电使电流广泛扩散至非目标组织,激活全身运动神经元。
不过,随着近些年生物物理工程技术的发展,科学家和工程师对于高压直流电的认识显著提升,有能力克服脉冲电场的缺点,避免其技术劣势。
纳秒级脉宽能显著降低肌肉强直等不良反应,也对产品的工程技术提出更高要求
脉宽为秒级,如同触电,瞬间夺获人的生命。
脉宽为毫秒级,如同电除颤,人体全部的肌肉会在电脉冲释放时瞬间绷直,难以忍受,仅适用于单次操作。
现在的脉冲电场消融多为微秒级,也常常需要全身麻醉下才能进行脉冲电场消融,比如国际上应用最多的波科的Farapulse产品。
而更先进的脉冲电场消融技术选择纳秒级脉宽。
纳秒级脉宽能显著降低肌肉强直的不良反应,同时,这也对工程实现提出了更高的技术要求。
首先,在相同的脉冲电压和脉冲频率下,脉宽越小,损伤深度越浅。因此,在细胞损伤深度相同时,纳秒级脉冲需要更高的脉冲电压,或者更高频的脉冲释放密度,这意味着需要在工程上使用更高的电压,更快的脉冲频率。
第二,在绝对高压的条件下,传统的导管管材耐压需要重新设计。在盐水或血液中,电极释放的高压直接击穿细胞产生电弧,电极之间的超高电压释放电解水会产生气泡,电弧、气泡随着电压的增加而显著提升,会导致潜在的脑缺血。因此,如何在保持损伤有效性的前提下,优化电极设计、电极分布、导管耐压以避免电狐、减少气泡是工程上的又一挑战。
不同脉冲参数下的生理效应对比
肿瘤治疗领域的现代突破,推动脉冲电场技术回归心脏消融领域
2005年,肿瘤治疗领域实现了对直流脉冲输出更加精准的控制,避免脉宽过高带来的众多副作用:微秒级短脉冲(1–10μs)的高压电场(1500–2400V)可在细胞膜上形成纳米级孔隙——即不可逆电穿孔(IRE)。
这一发现点燃了心脏消融技术革命,科学家对心肌细胞消融技术的关注点,从交流射频技术,又重新回到直流脉冲消融技术上:心肌细胞与其周围其他细胞相比具有特异性,心肌细胞的电穿孔阈值仅400V/cm,显著低于邻近的神经细胞(3800V/cm)和平滑肌细胞(1600V/cm),可以利用非热主导的脉冲电场消融,在极短的时间内实现组织温升仅5-10°C,保留细胞外基质和微血管结构,通过激活“线粒体凋亡通路”(细胞色素C→Caspase3/7),实现目标细胞的程序性凋亡, 选择性“杀死”目标细胞而不伤害其他神经细胞和平滑肌细胞:
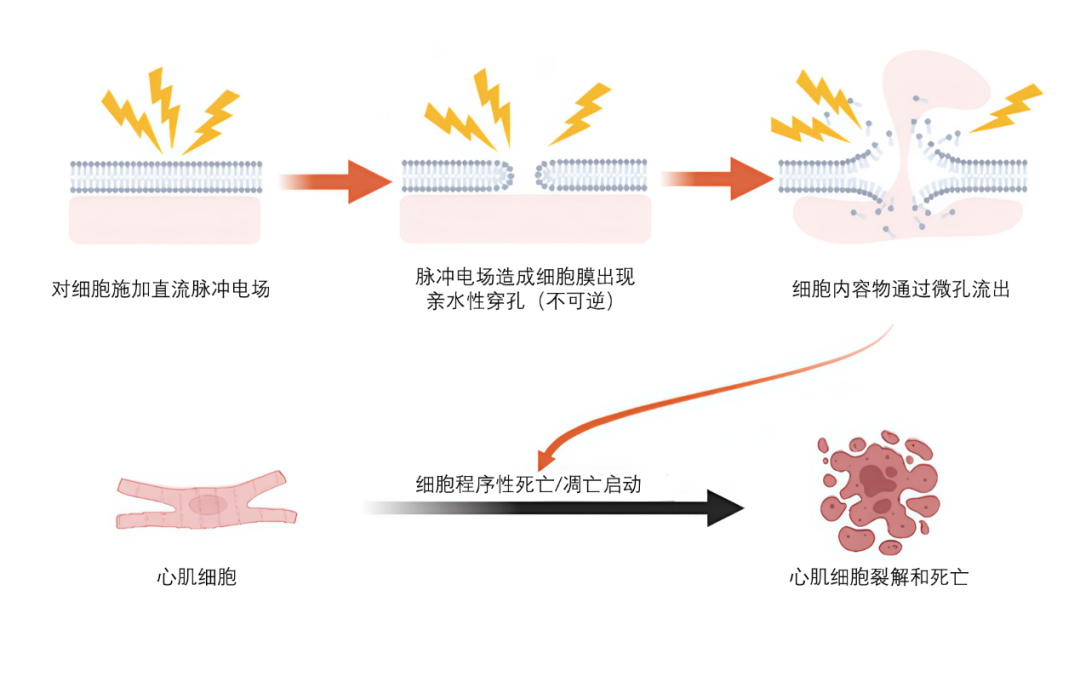
脉冲电场消融靶细胞的原理示意图
微秒级脉冲电场在肿瘤消融领域的效果有目共睹,基于上述原理,其迅速激发起医疗科技研发企业在脉冲电场上的热情。近年来,脉宽优化方面更进一步的纳秒级脉冲电场将患者的肌肉强直收缩效应降低到更小,已经接近射频消融时代的局麻/深镇静的手术要求。
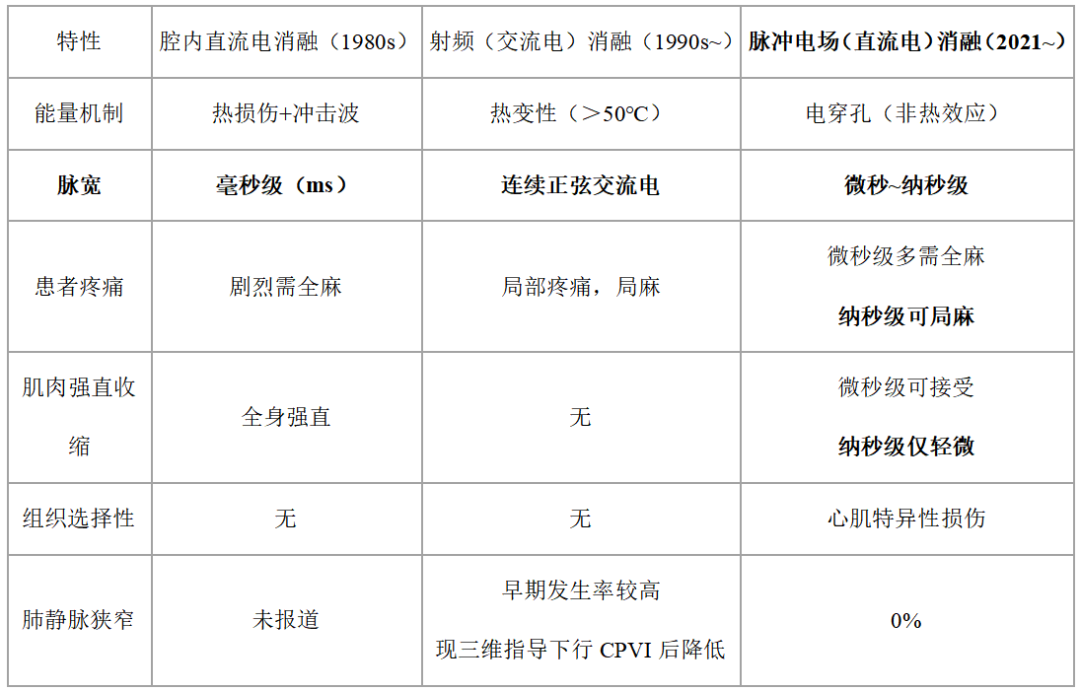
回望电流消融技术,从最开始的直流脉冲,发展到交流射频技术,再到现在的纳秒级直流脉冲消融技术,看似又回到了最开始的技术方式,但工程技术已远超五十年前的脉冲电场产品了。
现代PFA与传统消融技术比较
技术发展的轨迹如同螺旋上升,这场始于50年前的“驯电之旅”,终于让人类得以在心跳的微观宇宙中,用纳秒级的精准,书写生命律动的新篇章。