
复旦大学附属中山医院心内科黄浙勇教授
思辨介入困境
解析手术技巧
梳理中山经验
助您从新手变“心”手
每月15日、30日,严道医声独家发布
一
切割内膜的理论基础
大血管外科有一种手术叫开窗手术,指开通真假腔之间的连接,降低假腔压力,恢复真腔前向。借鉴开窗手术的经验,冠脉血肿也可采用切割内膜片的术式。
为实现真假腔的贯通,业界尝试过硬导丝穿刺[1]、刻痕球囊(包括棘突球囊[2]和导丝球囊等)、切割球囊等方法。尽管切割球囊的切割厚度最小(切割球囊显微刀片、棘突球囊特质尼龙、双导丝球囊金属导丝的切割厚度分别为0.13mm、0.39mm、0.36mm),但切割效率最高。
理论上,切割刀片能否切开内膜?切割球囊(以Wolverine™为例)的刀片工作高度为0.005 英寸(0.127 毫米),工作导丝直径为0.014英寸(0.35毫米),切割刀片大约是导丝直径的1/3。尸检正常人的冠状动脉壁厚度大约1mm,病理组织学测量内膜、中膜、外膜厚度分别为0.1mm、0.3mm、0.6mm。事实上,笔者OCT测量活体成人正常冠脉壁厚度为≥0.3mm(至少是切割刀片的2倍以上),其中内膜、中膜、外膜厚度分别为0.1mm、0.1mm、0.1mm左右。不管采信哪组数据,切割球囊均能轻松切破正常内膜,又不切破血管壁全层,因此血肿切割既安全又有效(图1)。
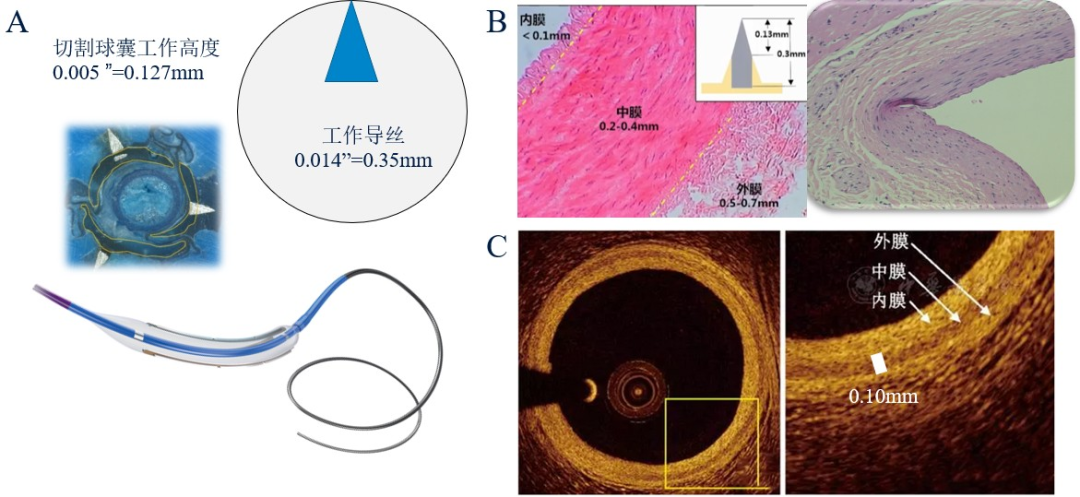
图1 切割球囊切割冠脉内膜的理论依据
A 切割球囊结构示意图;B 冠脉组织学厚度;C冠脉OCT厚度
必须指出,切割球囊必须防止在真腔内切割内膜片。如在假腔内切割,极有可能导致冠脉穿孔破裂(图2)。
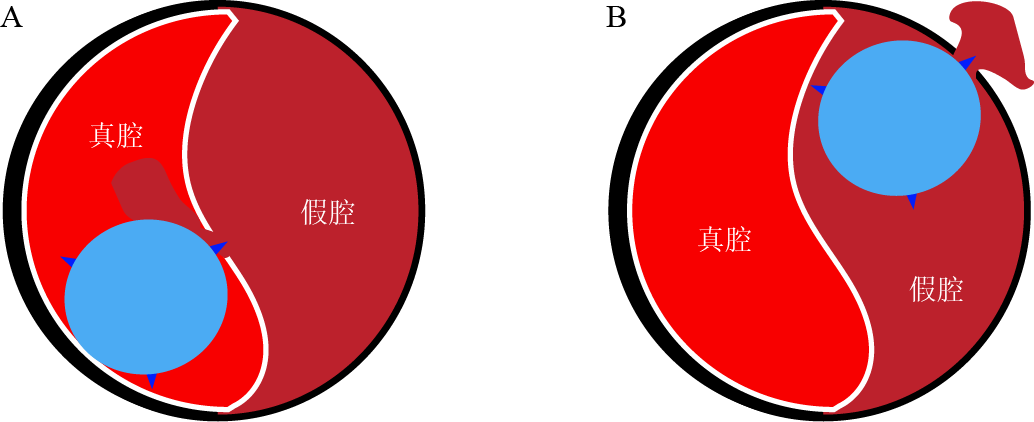
图2 壁内血肿切割球囊作用示意图[3]
A真腔内切割;B假腔内禁止切割
二
切割球囊治疗壁内血肿的技术要点
血肿切割的样本量非常有限(图3),2023年Bojan Maričić等[3]汇总分析32例自发性冠脉夹层(SCAD)的切割球囊个案, 87.5%切割成功,恢复TIMI3级血流。因此,本文关于切割球囊的技术要点是经验性的,甚至只是理论上的推理,供大家参考。
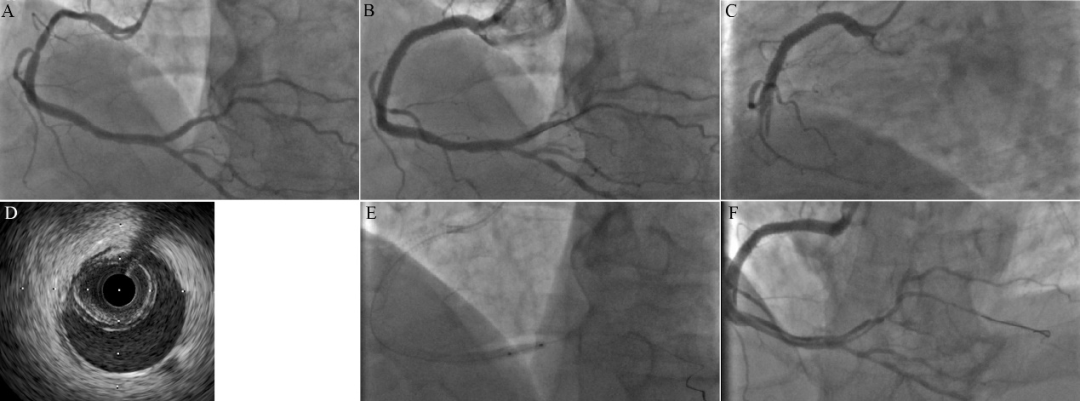
图3 冠脉壁内血肿的切割球囊治疗
57岁吸烟男性,反复胸闷1月。冠脉造影示粗大右冠近中段狭窄80%,左室后支和后降支狭窄40%(A)。右冠近中段植入4.0×38mm支架12atm释放,4.0×15mm NC球囊10-20atm×10秒后扩张,支架远端轻微oversize,未处理(B)。术后2小时,患者突发胸痛,伴恶心、虚汗,心电图示I、avL导联ST段弓背抬高0.2mV,II、III、avF导联ST段压低0.05-0.1mV,提示PCI相关急性心肌梗死。急诊造影示右冠中段支架远端边缘夹层征象,局部次全闭塞(C)。IVUS证实右冠远段至左室后支近段壁内血肿形成,导丝位于真腔(D)。IVUS确定血肿远端位置,Flextome 2.5*10mm切割球囊局部12atm扩张多次(E),造影示右冠中远段螺旋形夹层形成,但前向血流恢复TIMI 3级(F)。
1、切割球囊位置。切割开窗有2个目的:一是治疗,减轻血肿对真腔的压迫;二是预防,防止血肿的进一步延伸。由于球囊扩张本身可加重血肿的进展,因此对切割位点需要做一定的选择。(1)理想位置是血肿远端,该位置开窗不仅有助于血肿的消退,更重要的是能阻止血肿向远段延展。由于造影可能加重血肿进展,因此强烈建议IVUS确定血肿远端。(2)可选位置为分叉处,该位置切割不仅有助于开通分支血流,而且防止血肿向分支蔓延。③如血肿弥漫性延伸至末梢段,此时任何部位的切割应该都是合理的(图4)。
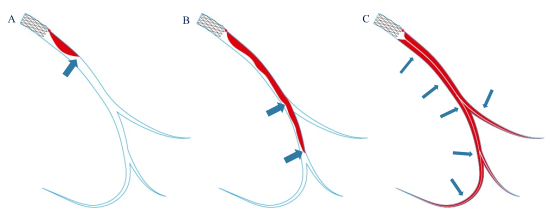
图4 切割位置选择
A 局限性血肿,建议血肿远端切割;B长程血肿,远端切割基础上可加分叉处切割;C弥漫性血肿,任何部位切割或回拉切割。
2、切割球囊直径。切割球囊既要确保切割效率,又要防止过度损伤血管。关于切割球囊直径选择,很多初学者感到茫然:一方面,产品说明书推荐切割球囊应稍大于血管直径(血管直径测量推荐“中膜-中膜”),两者之比是1.1 : 1;另一方面,不少术者为避免血管破裂并发症,建议两者之比例是0.8 : 1。孰对孰错?
笔者认为, “1.1标准”强调切割效果,参考直径并不一定是是血管直径,而是切割靶点的直径!根据不同的应用场景,切割靶点有不同的内涵(图5):(1)钙化环。切割靶点是钙化环,与血管直径无关。譬如血管直径4.0mm,钙化环内径2.0mm,切割球囊直径只要≥2.25mm即可;(2)冠脉开口或分叉口的纤维环:切割靶点是血管中膜附近纤维环,切割靶点为“中膜-中膜”血管直径,此时的切割靶点直径就是血管直径。(3)切开内膜防止血肿(譬如药球预处理时):切割靶点是病变处血管内膜。譬如血管直径4.0mm,狭窄处内径2mm,若旨在有序切开内膜/防止血肿,切割球囊只要≥2.25mm即可;若要打开纤维环防止弹性回缩,切割球囊直径宜选择4.0mm。(4)血肿开窗:切割靶点为真假腔之间的内膜片。譬如原始血管直径(或两端参考血管直径)为4mm,血肿节段血管直径为6mm,真腔内径为2mm,理论上切割球囊直径只要≥2.25mm即可,但鉴于内膜片的漂浮特性,可将原始血管作为切割靶点,因此,选择≥3mm的切割球囊应该也是合理的[4]。
由此可见,二个意见看似矛盾,实则统一。“切割靶点×1.1”保证疗效,“参考血管直径×0.8”保证安全,切割球囊的直径选择在该区间内,应该是比较安全合理的(图6)。

图5 切割靶点是切割球囊直径选择的基础
A钙化病变的切割靶点是钙化环;B开口或分叉病变的切割靶点是血管中膜纤维;C药球预处理的切割靶点是病变处血管内膜,或者血管中膜附近纤维环;D壁内血肿的切割靶点为真假腔之间的内膜片。
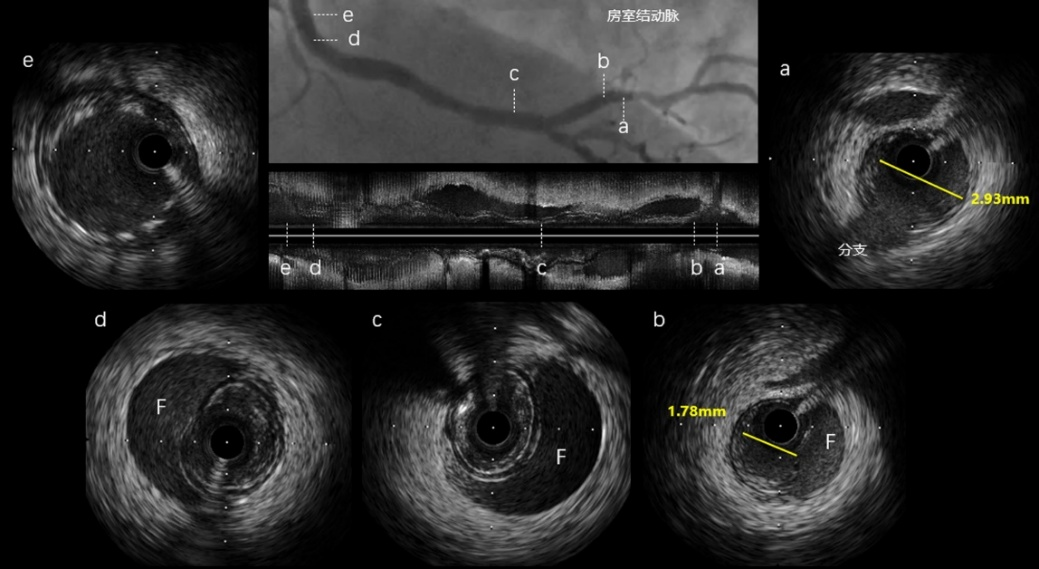
图6 IVUS指导下切割治疗(图3同一病例)
首先,IVUS确定血肿远端和正常交界的位置,位于房室结动脉发出点(a)之前。其次,IVUS测量血肿远端血管直径(a点2.93mm)和真腔内径(b点1.78mm),由此确定切割球囊直径约为2.5mm。最终2.5*10mm切割球囊切割成功。
3、切割球囊压力。切割球囊采用的是非顺应性球囊工艺(Flextome采用的Quantum NC球囊,Wolverine采用的是Emerge NC球囊)。Wolverine切割球囊的命名压6atm,增加到爆破压12atm时,球囊直径有所增加,大致增加10%左右:如2mm→2.2mm,3mm→3.3mm,4mm→4.4mm(图7)。因此,如开始选择的球囊直径偏小,可适当增加扩张压力。
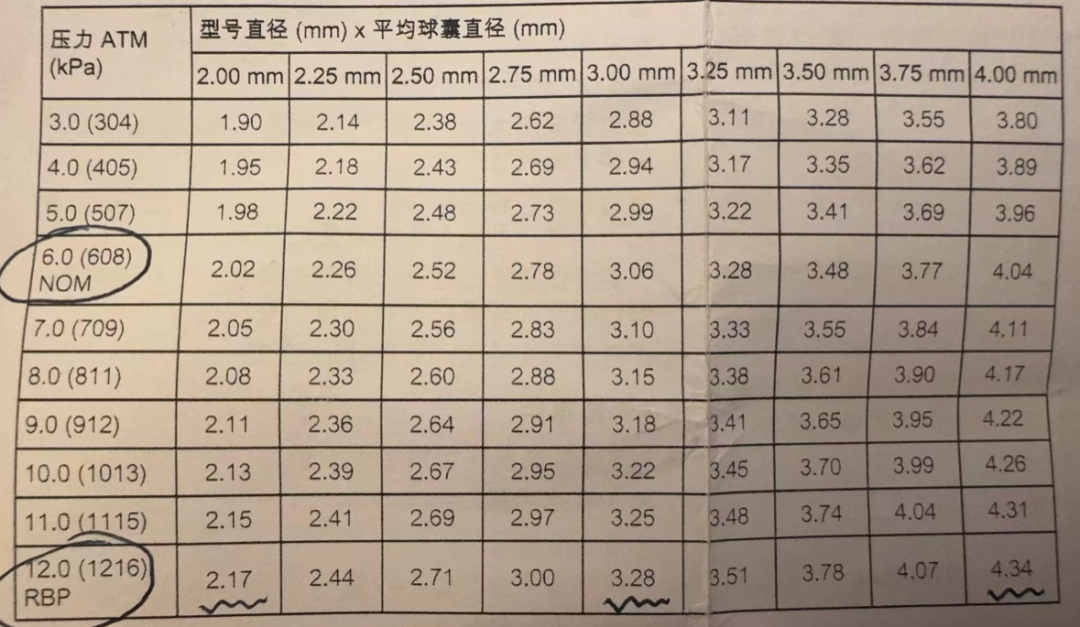
图7 Wolverine切割球囊的顺应性
切割球囊采用的是非顺应性球囊,尽管Wolverine等切割球囊的额定爆破压(体外试验99.9%的球囊不会破裂)是12atm,但是加压至20atm也很少破裂。但临床实践中我们不主张高压使用,为何?(1)不是怕破,而是怕刀片嵌顿,尤其是钙化病变。这是主要原因。(2)不是怕破,而是怕球囊回抱不良,影响回撤。建议可在较小空间内(譬如导管内)加压至4-6atm,然后减压,达到重新塑形的效果。(3)不是怕破,而是怕损伤内芯,从而球囊和导丝卡死,回撤球囊将带出导丝,这对血肿切割后局部夹层者,有潜在的风险。(4)切割球囊的特点就是压力聚能效应,较小的扩张压就能产生较大的切割效应,因此一般不必要使用高压扩张。
由于主要风险刀片嵌顿主要发生于钙化病变,在血肿切割时大多不存在此顾虑,因此可适当增加压力以增强切割效果,尤其是球囊选择偏小的时候。
三
强化切割球囊治疗
厨师切菜有三种切法(图8):一刀垂直下去,适用于较软食材,如豆腐、鱼肉等(直切);如不离断,就回拉或前推刀具,适用于韧性食材,如猪肉、鸡肉等(推切);再不离断,像锯木头一样来回拉刀切割,适用于硬性食材,如骨头或肉皮(锯切)!
借鉴大厨切菜经验,血肿切割也可采用推切和锯切的方案。理论上可用“压力聚焦”来解释。根据帕斯卡静压传递原理,普通球囊扩张压力分散到气囊表面(面),因此压强较小;切割球囊压力聚焦到刀片(线),压强增大;而切割球囊推拉运动时将压力进一步聚焦到更小部位(点),达到压强最大化,也就是切割力的最大化;来回锯切时,切割点不断变化,实现顺序切割。
在临床实践中,可根据需要谨慎采用“直切—推切—锯切”不断强化的切割球囊治疗(图9-11)。

图8 厨师切菜的三种切法
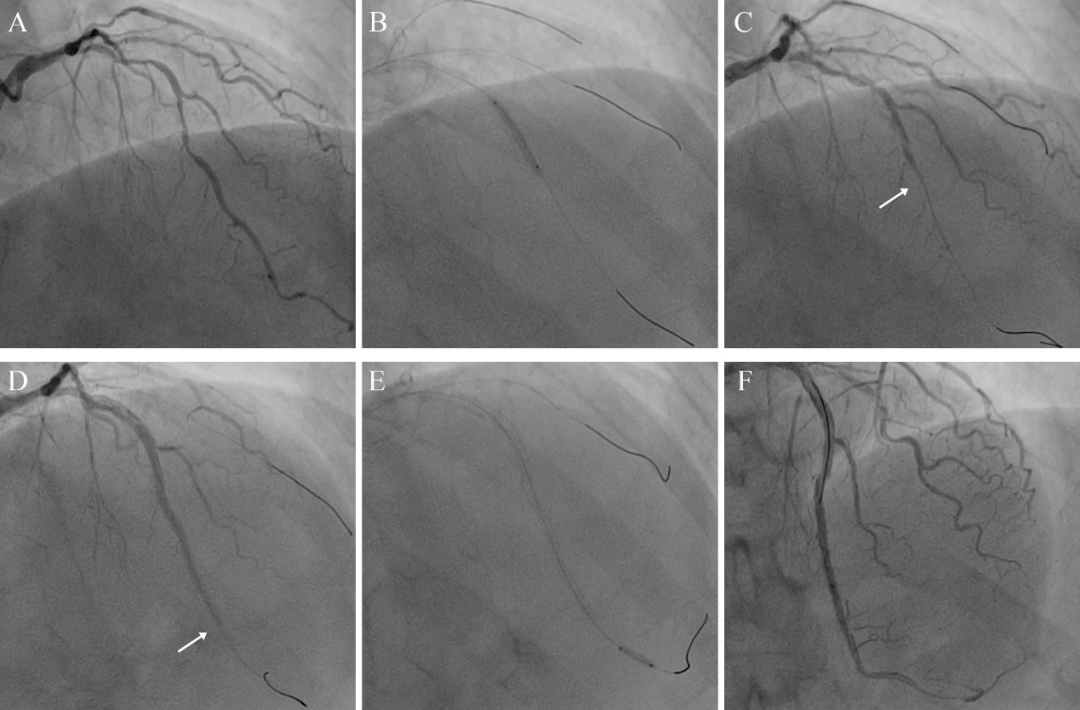
图9 强化切割治疗医源性壁内血肿
63岁高血压女性,胸痛半年,加重2月。冠脉造影示左主干至前降支近段重度钙化扭曲狭窄90%(A)。 25*15mm、3.0*12mmNC球囊前降支近中段14atm扩张(B),前降支血流中断(C),IVUS证实为夹层血肿。前降支远段至左主干串联植入2.5*23mm、2.5*29mm3.0*38mm支架,血流中断依旧(D)。Nolverine 2.0*10mm切割球囊10atm*10秒切割无效,予以强化切割(E):(1)压力增加至12-14atm,每次时间延长至10-20秒,反复切割5次;(2)额外增加一次操作:3at充盈后,前后推拉球囊进行锯切。最终前降支血流恢复TIMI3级(F)。
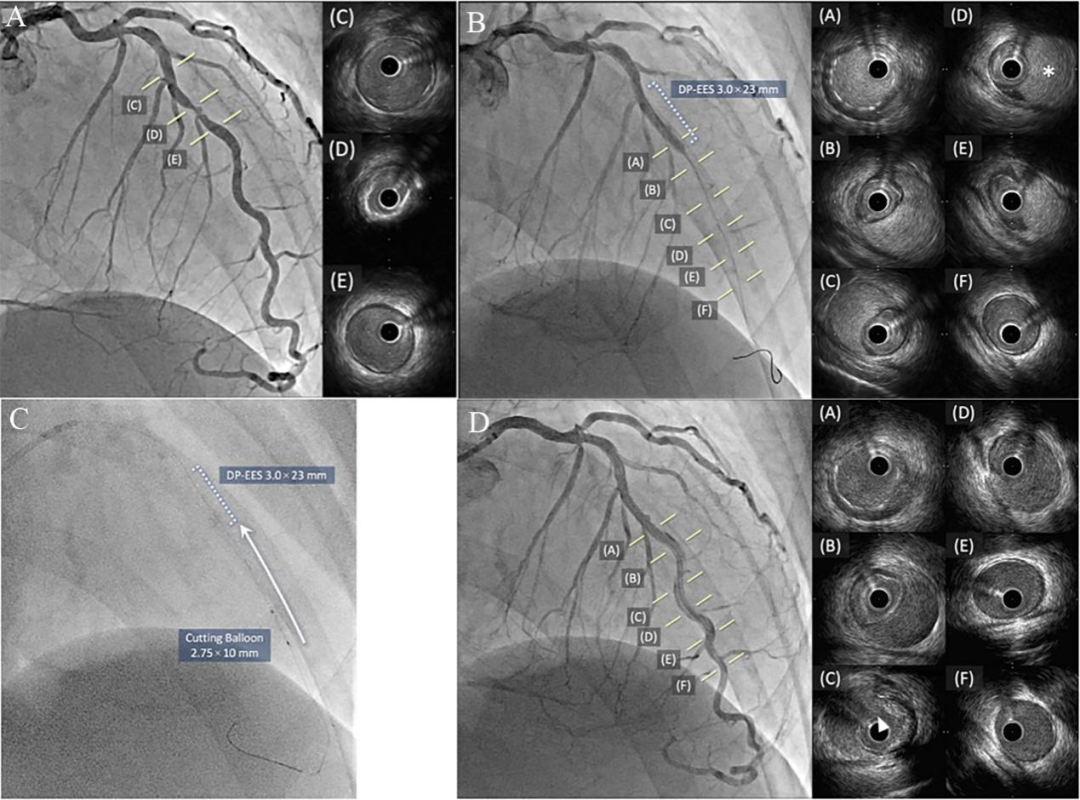
图10 推切法治疗医源性壁内血肿[4]
57岁男性,缺血性心肌病。 造影示右冠CTO和前降支中段严重狭窄伴钙化,先行前降支PCI治疗。IVUS指导下前降支中段置入3.0×23 mm支架,患者出现胸痛,伴心电图V4~V6导联ST段抬高,造影示前降支远端血流中断,IVUS证实自支架远端至前降支远段巨大壁内血肿(B)。2.0 mm半顺应性球囊扩张无效。继续追加支架? 但血肿过长,延伸至心尖部,支架难以覆盖血肿。因此尝试切割贯通真假腔。IVUS确定血肿远端位置,测量血肿以远正常血管节段直径为 2.5mm,血肿节段血管直径3.5 mm。2.5×10 mm Wolverine™ 定位于血肿远端切割扩张数次,但未获成功。考虑刀锋未有效接触内膜片!遂采用2.75mm切割球囊6atm扩张,然后朝支架方向轻轻回拉(C)。效果立竿见影:胸痛立即消失,ST段回落。IVUS提示血肿缩小,提示开窗成功(D)。造影发现血流恢复TIMI3级,局部伴长程夹层形成(D)。由此可见,切割球囊小压力扩张状态回拉是医源性血肿的一种高效处理方式。
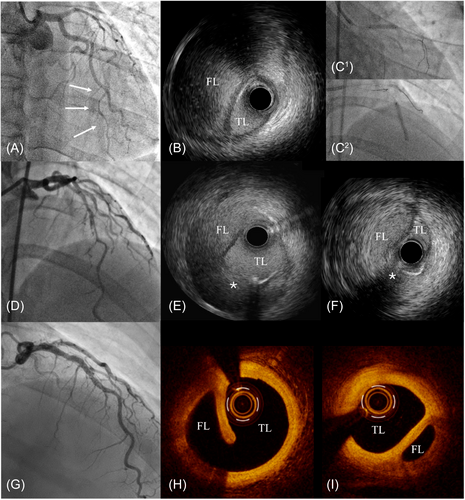
图11 锯切法治疗壁内血肿[5]
45岁女性,前壁STEMI。冠脉造影示前降支自发性夹层,血流 TIMI 1 级(A)。导丝通过夹层,IVUS确认进入真腔(B)。使用锯切技术(C1, C2)后恢复3级 TIMI 血流(D)。 IVUS 评估显示假腔和真腔之间有内膜撕裂,血肿大小显著减小(E,F),未植入支架。6 个月后冠脉造影显示前降支通畅(G),OCT 显示血肿完全吸收以及锯切产生的内膜撕裂部分愈合(H,I)。
四
普通球囊模拟切割效果
球囊操作指南告诉我们,球囊回撤必须在充分回抱后进行。在球囊未充分回抱前撤离球囊,可诱发指引导管的深插、球囊局部血管内膜/斑块的损伤、球囊的嵌顿(图15)。注意:球囊半充盈或充盈状态下回撤,可诱发斑块或内膜的破裂!正常状态下,内膜撕裂是并发症;壁内血肿时,真假腔破口是治疗手段!因此,在球囊半扩张或扩张状态下小心的回拉球囊,可提高开窗成功率[4](图16)。在没有切割球囊的条件下可以尝试回拉普通球囊,也有成功的可能性[6](图17)!

图15 切割球囊说明书。
反言之,球囊部分扩张状态下重新定位(位移)可导致血管内膜的破裂,从而提高血肿切割效率
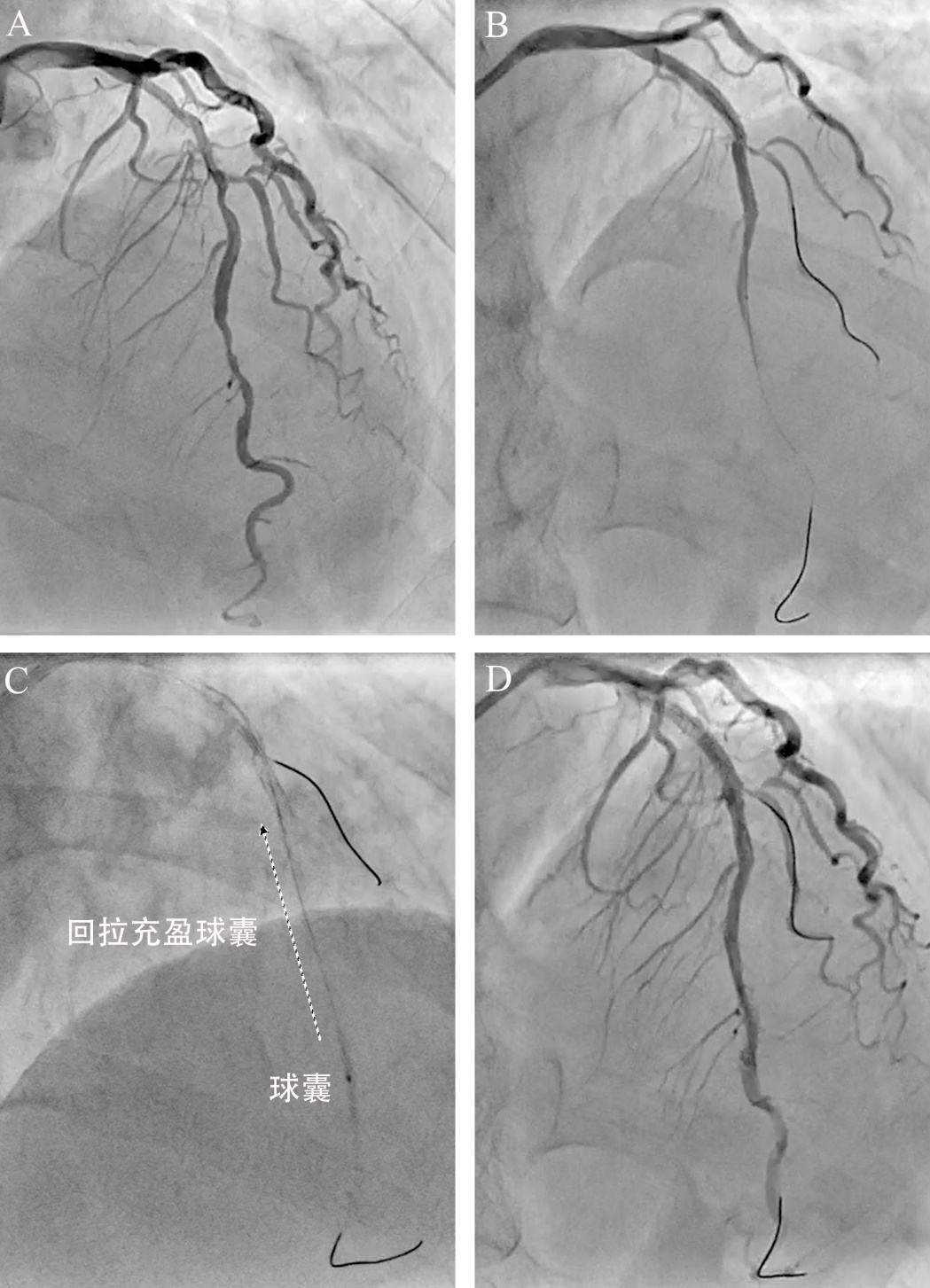
图16 普通球囊扩张状态回拉治疗医源性冠脉血肿
63岁女性,活动后胸闷1年余。冠脉造影显示前降支近段长病变狭窄80%伴钙化,中段狭窄80%(A)。压力微导管测量前降支FF 0.61。前降支中段预处理后2.5*20mm药物球囊8atm扩张60秒。近段置入3.0*38mm支架10atm释放。交换重置第一对角支导丝时,前降支导丝前进困难,复查造影发现前降支支架远段夹层形成伴TIMI血流1级(B)。将导丝重新置入前降支远段,IVUS证实导丝位于真腔。1.5*15mm球囊10atm*10秒扩张夹层节段,然后扩张状态下回拉(C),前降支远段恢复TM血流3级(D)。
最后,再次强调,切割球囊的操作前提是确保导丝位于真腔内!假腔壁薄,假腔内的任何操作均存在假腔扩大、冠脉穿孔的风险(图17)。尤其是切割球囊过大或压力过大,或者采取推切或锯切等强力切割时,更容易导致穿孔并发症(图2)。
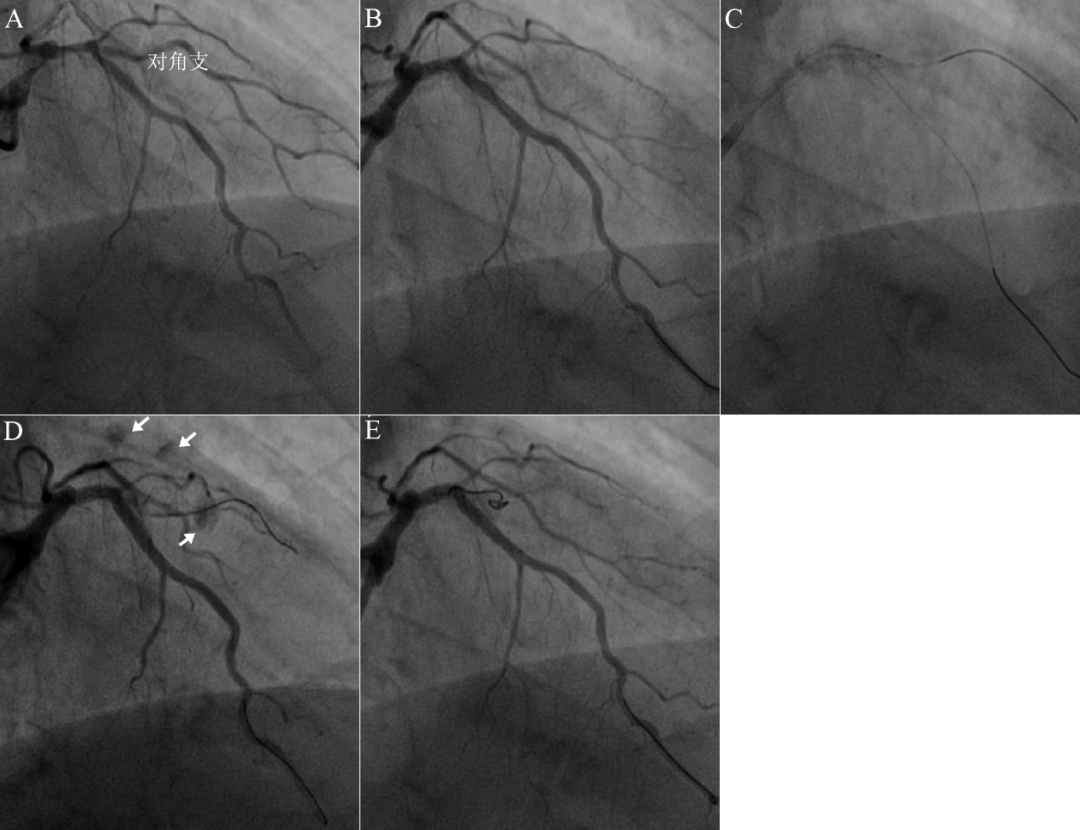
图17 夹层内小球囊低压回撤,导致血管破裂
74岁高血压男性,活动后胸闷4年。冠脉造影显示左主干远段狭窄95%伴严重钙化,前降支近段严重钙化迂曲,狭窄70%。累及粗大对角支开口狭窄80%。球囊拘禁技术保护对角支,前降支-左主干串联植入2.75*13mm和3.5*13mm支架,后扩张后对角支闭塞!Pilot50导丝掏分支进入“对角支”中远段,手感顺利,1.5mm球囊扩张对角支开口,未显影。考对角支血肿形成,1.5mm球囊4atm扩张后从对角支中段回拉至前降支,复查造影对角支局部外渗,提示对角支穿孔破裂!2mm*30mm Cook弹簧圈封堵成功。本例说明,切割球囊低压回撤技术或小球囊低压回撤技术有前提条件,即位于血管真腔!否则,造成严重的血管损伤甚至破裂。
“中山PCI解码”下期预告
体内反转导丝技术解码


