
引言:作为经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的一部分,支架植入(stent implantation)仍系治疗急性冠状动脉综合征(acute coronary syndromes,ACS)和慢性冠状动脉综合征(chronic coronary syndromes,CCS)的关键手段。PCI可改善总体结局,包括减轻症状负担,且在ACS患者中尤能降低未来冠状动脉血栓事件的风险;但这一获益会被一种危及生命的并发症(支架血栓)所削弱。因此,将支架血栓风险尽可能降至最低,对PCI的长期成功至为关键。预防支架血栓(stent thrombosis)离不开有效的抗栓药物(antithrombotic drug),同时亦依赖于确保支架最佳释放技术(例如采用冠状动脉腔内影像)。不过,抗栓药物虽进一步降低非支架相关的血栓事件,但亦可增加出血风险,从而限制其总体效益。
本文综述支架设计、释放策略与抗栓药物治疗的进展,评估其对临床结局的影响,并探讨近期趋势与研究可能如何塑造PCI的未来。
冠状动脉支架的演进
从单纯球囊扩张到药物洗脱支架
Andreas Gruentzig(1939–1985)于1977年使用自制的聚氯乙烯(polyvinyl chloride)球囊完成了首例冠状动脉成形(coronary angioplasty)。尽管“单纯球囊扩张成形术”(plain old balloon angioplasty,POBA)的即刻效果往往令人满意,但其局限性显著:短期内包括病变动脉壁回缩以及夹层所致急性血管闭塞;长期则因持续粥样硬化相关炎症所驱动的新生内膜增生(neointimal proliferation)而易发生再狭窄(restenosis)。为解决这些问题曾提出多种途径,但最终,冠状动脉支架成为减轻回缩并处理影响血流的血管夹层的主要策略。
早期支架(现称裸金属支架,bare metal stents,BMS)包括自膨式Wallstent,其于1984年首次植入人类冠状动脉。随后在1990年代,球囊扩张型不锈钢支架(如Palmaz–Schatz)占据主导地位。这类支架显著减少回缩并降低了急性血管闭塞(acute vessel closure)这一并发症;在BENESTENT与STRESS等试验证实BMS优于POBA之后,支架植入遂成为PCI的主要策略。然而,由新生内膜增生介导的支架内再狭窄(in-stent restenosis,ISR)问题仍然突出;同时新增的支架血栓风险——在支架支架梁完成内皮化之前最为显著——亦限制了总体疗效。为降低再狭窄风险,将BMS与局部递送的抗增殖药物(antiproliferative drug)相结合,促成了药物洗脱支架(drug-eluting stent,DES)的出现。DES的应用显著降低了ISR风险,但随着临床经验的积累,人们认识到这一获益部分被更高的支架血栓风险(包括极晚期事件)所抵消。
药物洗脱支架的演进:从“厚且生物不相容”到“薄且生物相容”
自药物洗脱支架问世以来,其设计持续优化,尤以支架平台(platform)、聚合物(polymer)与药物(drug)为甚;同时,诸如支架网格设计(cell design)等方面亦有所进展。当前临床植入的冠状动脉支架以不同构型的DES为主(见表1)。尽管已有关于冠状动脉支架评价的共识建议,流程包括非临床评估后开展大规模随机对照试验(randomised controlled trial,RCT),但不同DES设计间的临床结局比较依然困难。这主要因为该领域的RCT通常按“非劣效”设计并以支持器械获批为主要目的,常以‘靶病变失败’(TLF)为主要终点,包含心源性死亡、靶血管心肌梗死及具有临床指征的靶病变血运重建。支架血栓的研究尤为棘手:其虽为潜在的灾难性并发症,但总体发生率低;即便发生,也未必总能得到及时诊断或充分调查,故需将事件判定为可能(possible)、很可能(probable)或确切(definite)。不过,通过整合数据——包括观察性研究与机制学研究——有助于更好理解不同设计差异所带来的影响。
表1 目前可用药物洗脱支架(DES)及其设计特性举例
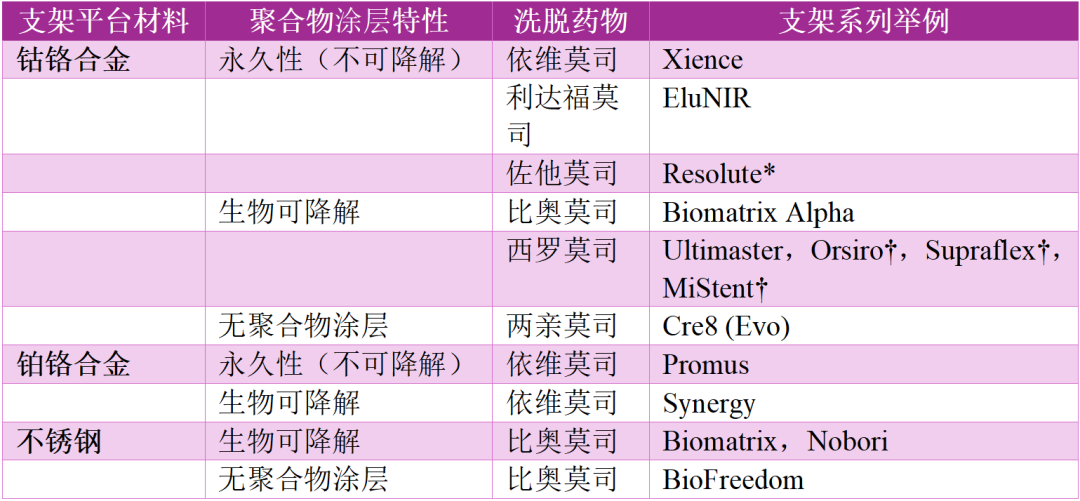
* Resolute:外层为钴铬合金,内芯为铂铱合金。
†“超薄支架梁”DES(支架梁厚度 < 70 μm)。超薄支架条药物洗脱支架(ultrathin-strut DES,支架条厚度<70 μm)。
DES,药物洗脱支架(drug-eluting stent)。
支架平台
大多数早期药物洗脱支架(DES)采用不锈钢制造(Biomatrix、Nobori 等仍沿用),现今则以铬基合金为主,因其具有更高的拉伸强度。由此在维持足够径向强度的前提下,可将支架梁厚度显著降低(约由 120–140 μm 降至 80–100 μm)。除提升柔顺性与可输送性能(deliverability)外,支架梁尺寸亦是支架血栓和侧支分支闭塞风险的关键决定因素之一。
聚合物涂层
为负载药物,早期药物洗脱支架(DES)通常在支架平台上覆以 10–15 μm 的永久聚合物层,如聚乙烯-乙烯醋酸乙烯共聚物(poly(ethylene-co-vinyl acetate), PEVA)或聚正丁基甲基丙烯酸酯(poly(n-butyl methacrylate), PBMA)。临床与动物研究显示,这些聚合物生物相容性较差,增加支架血栓风险。为提升DES安全性,主要出现四类改进:① 采用生物相容性更好、血栓原性更低的聚合物(如氟聚合物或两亲性聚合物);② 将聚合物层减薄,通常至 5–10 μm;③ 使用生物可降解聚合物(如聚乳酸类);④ 取消聚合物涂层,使药物直接负载于合金平台的外腔面(abluminal)。现有比较显示,薄层生物相容/可降解聚合物DES与无聚合物DES在临床结局上整体差异不大,提示两种路径在血栓风险方面大致相当。
药物
总体而言,作为DES活性成分的抗增殖药物主要分为两类:紫杉烷类(如紫杉醇 paclitaxel)与mTOR 抑制剂(统称“莫司“类)。二者均通过阻滞细胞分裂以抑制新生内膜增生,但作用机制不同。与“莫司“类洗脱器械相比,紫杉烷更易导致内皮化延迟,从而带来较差的临床结局,其中包括支架血栓风险更高;研究提示“莫司“类洗脱支架的血栓风险约为紫杉醇洗脱支架的三分之一,这也促使近年的DES更倾向采用“莫司“类药物。当前常用的“莫司“类包括西罗莫司(sirolimus)、依维莫司(everolimus)、佐他莫司(zotarolimus)及优美莫司(Biolimus A9,umirolimus)。此外,西罗莫司与脂肪酸复配可形成两亲性复合物——两亲莫司(amphilimus),被认为有利于增强冠状动脉内皮的药物摄取,尤其在糖尿病患者中可能更有益。以此为载药的两亲莫司洗脱支架(Cre8 EVO)在 SUGAR 研究中与佐他莫司洗脱支架(Resolute Onyx)比较:在预设界值下前者于靶病变失败(TLF)方面达成不劣效,在探索性分析中呈现优效;但由于两者在支架设计上尚存其他差异,难以将结果作严格的一对一归因。
第一代与第二代药物洗脱支架(DES)
DES 的演进常以“世代”划分来概括。第一代(如 Cypher、Taxus):不锈钢平台,支架梁厚度 120–140 μm,永久性聚合物涂层,载药为 “莫司”类 或紫杉烷。第二代(如 Promus、Xience、Resolute):铬基合金平台,支架梁厚度 80–100 μm,采用生物相容性更高的永久性聚合物(厚约 5–10 μm),载药为 “莫司” 类。
第三代药物洗脱支架(DES)
最新一代DES多采用生物可降解聚合物或无聚合物涂层设计(见表1)。部分新近的铬基合金系统具有超薄支架梁(<70 μm)和极薄生物可降解聚合物层。多项随机对照试验已将其与第二代DES比较,结果显示在靶病变失败(TLF)与主要不良心血管事件(MACE)方面至少非劣效(见表2),且有荟萃分析支持。更薄的支架梁可能提升可输送性能并加速内皮化;但也有担忧认为,在慢性完全闭塞(chronic total occlusion,CTO)等复杂病变中,较高的回缩(recoil)概率或影响释放效果,较之常规第二代DES可能增加远期并发症风险。
表2 超薄支架梁生物可降解聚合物西罗莫司洗脱支架与薄支架梁永久性聚合物涂层依维莫司洗脱支架的随机对照试验举例
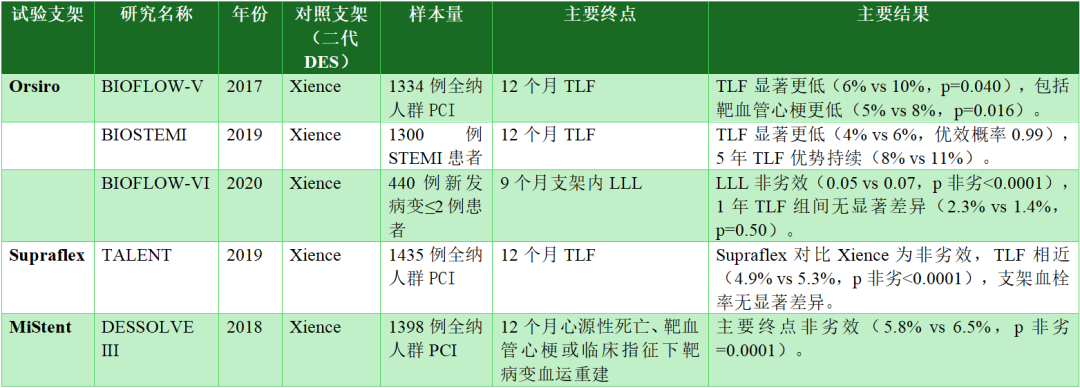
TLF为心源性死亡、靶血管心肌梗死或临床指征下靶病变血运重建的复合终点。
LLL,晚期血管腔丢失(late lumen loss);MACE,主要不良心血管事件(major adverse cardiovascular events);MI,心肌梗死(myocardial infarction);PCI,经皮冠状动脉介入治疗(percutaneous coronary intervention);STEMI,ST段抬高型心肌梗死(ST-elevation myocardial infarction);TLF,靶病变失败(target lesion failure)。
支架植入方式的演进
自药物洗脱支架(DES)问世以来,除设计与制造显著进步外,对“最佳植入”的重要性及其实现路径也有了更深认识。以血管内超声(intravascular ultrasound,IVUS)与光学相干断层成像(optical coherence tomography,OCT)为代表的冠脉内成像,使支架尺寸选择更精确,并提升了对贴壁不良(malapposition)、扩张不足(underexpansion)与边缘夹层(edge dissection)等问题的识别,尤其在复杂病变及溯源支架失败时信息量更大。尽管IVUS/OCT问世已久,近年其可及性、培训与应用明显增加,但总体使用率仍然偏低。当前已有累积的临床试验证据支持冠脉内影像指导的PCI(包括近期的RENOVATE COMPLEX PCI试验),且最新版欧洲心脏病学会(European Society of Cardiology,ESC)慢性冠状动脉综合征(CCS)指南在解剖复杂病变(尤指左主干、分叉及长病变)PCI中,将使用IVUS或OCT列为I类、A级推荐。预期未来使用频率将进一步提升;即便在未采用成像的病例中,相关证据与共识也已促使临床更重视病变预处理、支架尺寸选择与后扩张。
PCI患者抗血栓治疗的演变
PCI患者抗血栓治疗的理论基础
总体而言,PCI 患者接受抗栓治疗的预期获益可概括为三方面。
促进冠脉内器械操作的安全性
术中抗凝可降低导管或器械在操作过程中发生血栓的风险,并带来额外获益,如经桡动脉入路 PCI 后提高通路血管的术后通畅率。术中抗凝可选用普通肝素(unfractionated heparin,UFH)、低分子量肝素(low-molecular-weight heparin,LMWH)、直接凝血酶抑制剂比伐卢定(bivalirudin);若患者已在口服维生素 K 拮抗剂(vitamin K antagonist,VKA)治疗且 INR>2.5,亦可作为术中抗凝方案。只要抗凝管理得当,术中血栓形成的风险应接近于零。
预防支架血栓形成
尽管在 ACS 等情形下,支架植入可降低总体血栓风险,但支架本身亦具血栓原性(thrombogenic)。从 Virchow 三联征出发,支架既改变血管壁特性,又可引起微流场(microflow)改变并产生湍流(turbulence);其材料(包括当前常用的各类合金)不仅直接启动凝血的接触激活通路,亦可活化血小板与白细胞。此外,支架通常覆盖并扰动粥样斑块,因而可在短期内加剧局部促血栓环境。支架血栓风险主要受植入后时间影响,同时亦与支架设计、长度与直径等因素相关(见图1)。
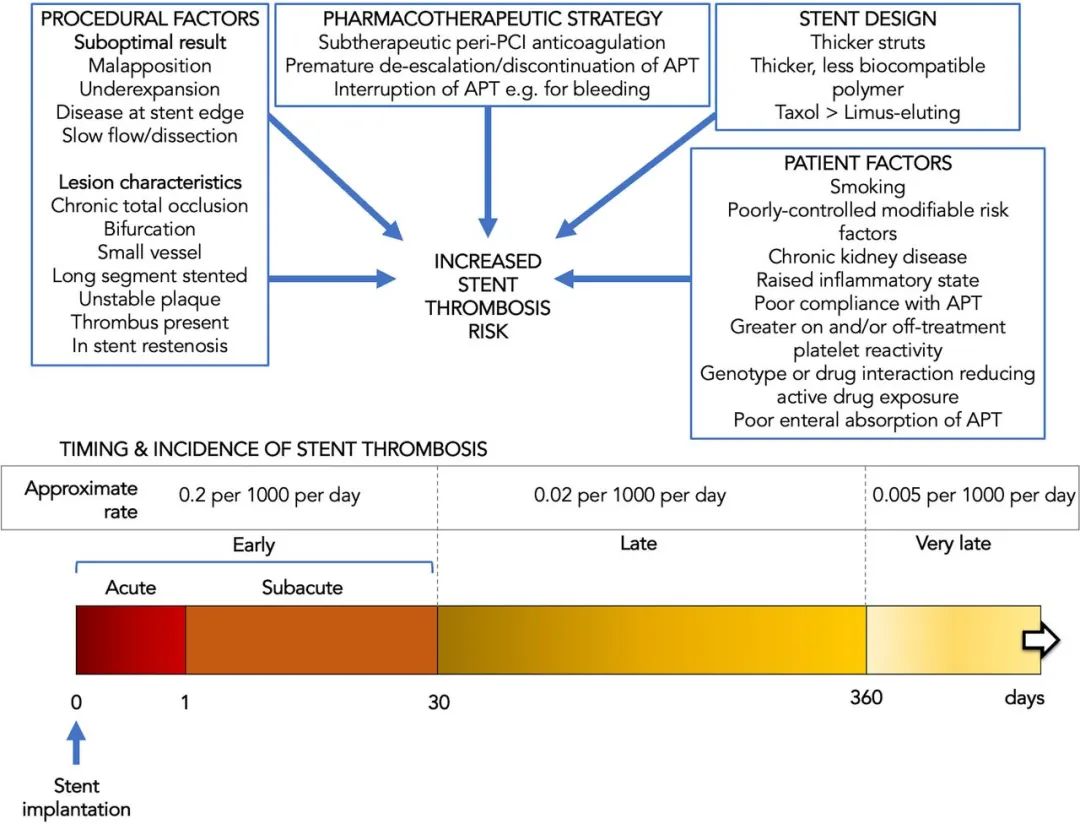
图1 支架血栓风险的影响因素示例(上)及植入后时间对其风险的影响(下)。所示发生率为近似值,基于当前代药物洗脱支架(DES)在全纳人群的数据(见文献66)。APT=抗血小板治疗;PCI=经皮冠状动脉介入治疗。
尽管术中抗凝可降低急性支架血栓风险,但药效消退后,预防主要依赖口服抗栓治疗。常用药物及其作用机制(见图2)。
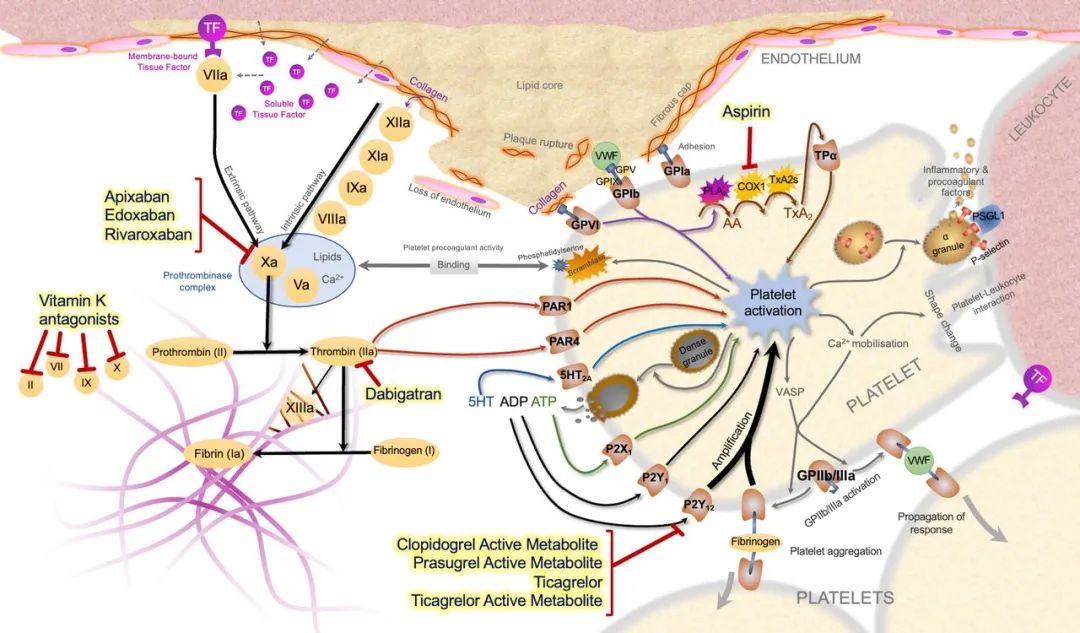
图2 血栓反应的病理生理与口服抗栓药物的作用机制。引自 Parker WAE 与 Storey RF(文献3)。
5-HT,5-羟色胺(serotonin);AA,花生四烯酸(arachidonic acid);ADP,腺苷二磷酸(adenosine diphosphate);ATP,腺苷三磷酸(adenosine triphosphate);Ca²⁺,钙离子(calcium);COX-1,环氧合酶-1(cyclo-oxygenase 1);GP,糖蛋白(glycoprotein);IXa,活化因子IX(activated factor IX);P2X1,血小板ATP受体(platelet ATP receptor);P2Y1/P2Y12,血小板ADP受体(platelet ADP receptors);PAR,蛋白酶激活受体(protease-activated receptor);PLA₂,磷脂酶A₂(phospholipase A2);PSGL-1,P-选择素糖蛋白配体-1(P-selectin glycoprotein ligand 1);TF,组织因子(tissue factor);TPα,血栓烷受体α亚型(thromboxane receptor α);TXA₂,血栓烷A₂(thromboxane A₂);TXA₂s,血栓烷A₂合酶(thromboxane A₂ synthase);Va,活化因子V;VIIa,活化因子VII;VIIIa,活化因子VIII;VASP,血管扩张剂刺激磷蛋白(vasodilator-stimulated phosphoprotein);vWF,血管性血友病因子(von Willebrand factor);Xa,活化因子X;XIa,活化因子XI;XIIa,活化因子XII;XIIIa,活化因子XIII。
降低与非靶病变相关的动脉粥样硬化性血栓事件风险
除支架血栓外,PCI 患者仍存在与靶病变无关的动脉粥样硬化性血栓事件风险;这些事件可发生于冠状动脉树的其他节段,亦见于其他血管床(如脑动脉或外周动脉)。该风险的大小取决于患者的粥样斑块负荷及其他未来事件的危险因素(见框1)。抗栓治疗可降低此类非靶病变相关的临床事件风险。
框1 欧洲心脏病学会(ESC)2024年慢性冠状动脉综合征(CCS)指南界定的“扩展缺血风险”因素

平衡抗血栓获益与出血风险
鉴于血栓形成与止血同源于同一套生理机制,抑制血栓的药物必然增加出血风险。出血不仅显著影响生活质量并推升医疗成本,更重要的是,重度出血的死亡风险可与重大心血管事件相当;同时,因应激反应或因医嘱/患者自行中断抗血栓治疗,还可能进一步提升缺血风险。故此,出血风险是限制抗血栓治疗净临床获益的关键约束。权衡两类风险时,ESC 指南强调:使用 PRECISE-DAPT、ARC-HBR 等评分识别高出血风险人群,并在 PCI 受术者中评估缺血风险是否为中度、高度及/或延长(见表3)。尽管上述评分具有实用价值,但亦存局限;最新研究提示,将二者要素整合而成的 PRECISE-ABR 评分在出血风险的辨别力上可获得中等幅度改进。
表3 无口服抗凝指征的 ACS/CCS 患者行 PCI 时口服抗栓治疗(ATT)的 ESC 推荐摘要
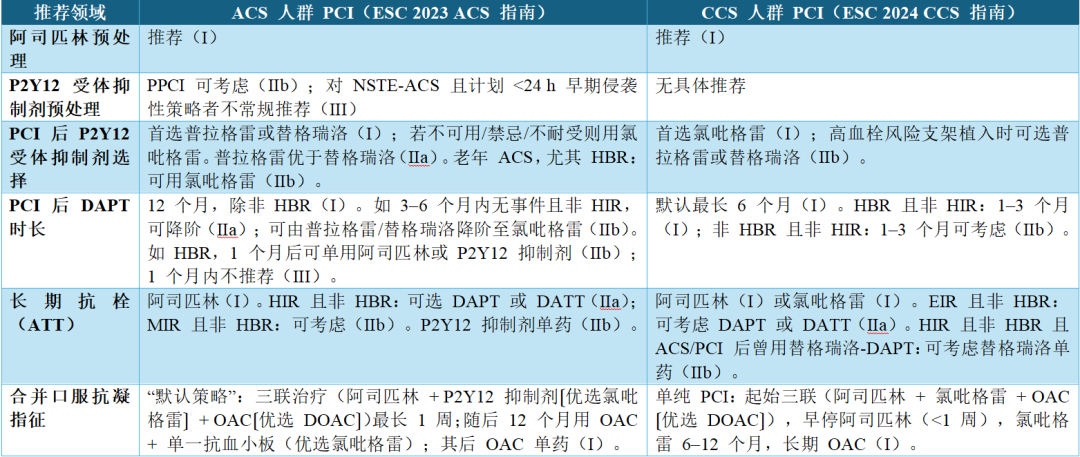
注: 括号内为推荐强度——I:推荐;IIa:应考虑;IIb:可考虑;III:不推荐。
缩略语:ACS=急性冠脉综合征;ATT=抗栓治疗;CCS=慢性冠脉综合征;DAPT=双联抗血小板(阿司匹林+P2Y12 抑制剂);DATT=双联抗栓(阿司匹林+低剂量利伐沙班);DOAC=直接口服抗凝;EIR=延长缺血风险;ESC=欧洲心脏病学会;HBR=高出血风险;HIR=高缺血风险;MIR=中等缺血风险;NSTE-ACS=非 ST 段抬高型 ACS;OAC=口服抗凝;PCI=经皮冠脉介入;PPCI=急诊 PCI。
PCI患者口服抗栓治疗的现行选择与推荐
早期冠脉支架患者多采用多药联用;随着经验累积,术后主流抗栓方案一度转为阿司匹林单药。随后证据表明,在接受 PCI 的 ACS 或 CCS 患者中,在阿司匹林基础上加用P2Y12 受体抑制剂(即双联抗血小板治疗,DAPT,如氯吡格雷),较单用阿司匹林可显著降低主要不良心血管事件(MACE)风险。
氯吡格雷为噻吩吡啶类前药,其活性代谢物与 P2Y12 受体不可逆结合;但其代谢活化依赖 CYP2C19 通路,可靠性欠佳,致约三分之一用药者出现抗血小板作用不足。随后开发并验证了普拉格雷和替格瑞洛:前者同属噻吩吡啶类前药,代谢激活更为可靠;后者为环戊三唑并嘧啶类药物,可逆结合 P2Y12 受体且无需代谢活化。在接受阿司匹林治疗并行 PCI 的 ACS 患者中,二者较氯吡格雷均可降低主要不良心血管事件(MACE)风险。而在进行 PCI 的 CCS 人群中,尽管替格瑞洛为基础的 DAPT 较氯吡格雷为基础方案血小板抑制更稳定一致,但尚无证据表明其能转化为更优的与 PCI 相关临床结局。
当前 ESC 指南对 PCI 后抗栓治疗的要点见表3。对合并口服抗凝指征(以房颤最常见)的患者,管理尤具挑战;但现有临床试验证据支持早期停用阿司匹林、在一段时间内给予P2Y12 受体抑制剂,并持续口服抗凝的策略。此类人群的方案仍有优化空间;例如,暂时停用口服抗凝、改用一段时期的 DAPT以权衡缺血与出血风险的替代路径目前正被研究(WOEST-3,NCT04436978;MATRIX-2,NCT05955365)。
支架与抗栓治疗的协同演进:未来走向
本篇所述的支架设计、植入策略与抗栓治疗的进步,已共同促成 PCI 术后心血管风险(包括支架血栓)的大幅下降。
此外,PCI 患者管理中其他与血栓风险相关的环节也与之同步提升(见图3)。虽非严格意义上的“药物抗栓”,但危险因素管理(如高胆固醇血症、高血压、糖尿病)及生活方式干预(如戒烟)对降低血栓风险同样贡献显著。自冠脉支架与抗栓治疗问世以来,我们对危险因素控制目标更为清晰、可用工具亦更丰富。以冠状动脉疾病(CAD)为例:自 2010 年起,高强度他汀处方率约提升三倍;同期该人群血压显著下降,吸烟率约减半。
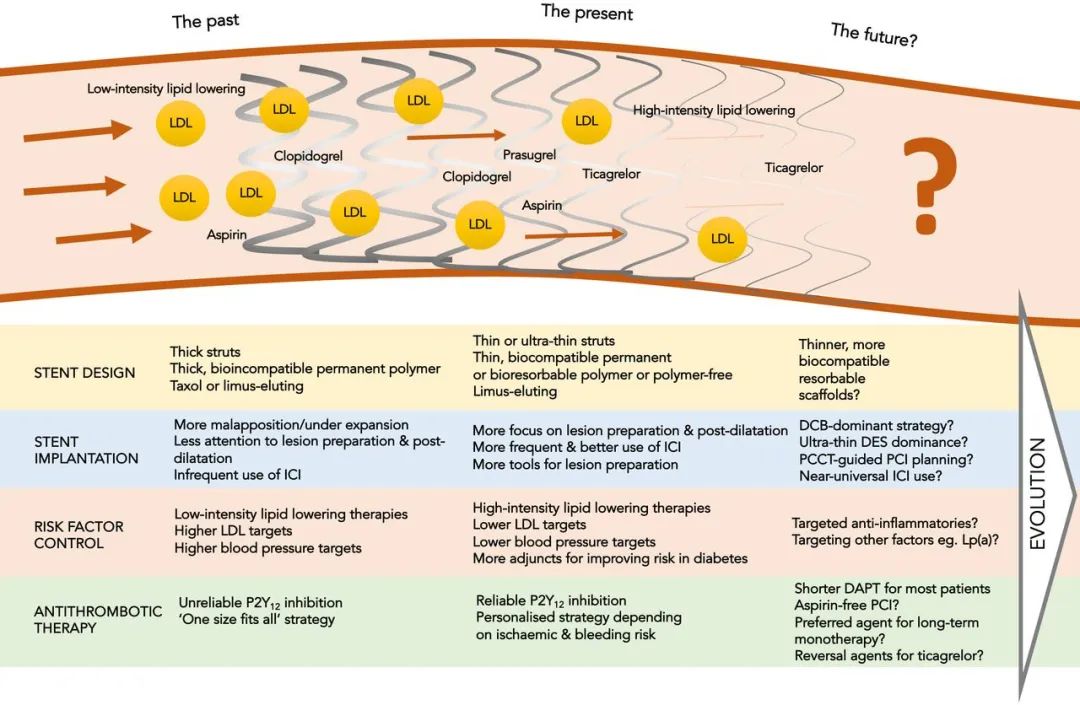
图3 自药物洗脱支架(DES)引入临床以来,影响 PCI 后支架血栓风险的相关因素之演变。
DAPT=双联抗血小板治疗;DCB=药物涂层球囊;DES=药物洗脱支架;ICI=冠脉内成像;LDL=低密度脂蛋白;Lp(a)=脂蛋白(a);PCCT=光子计数CT(photon-counting CT);PCI=经皮冠状动脉介入治疗。
在对更广范围血栓风险因素的管理不断改进、支架技术迭代以及更可靠的抗血小板方案加持下,在维持支架血栓防护的前提下更早进行 DAPT 降阶或已具可行性,且相关证据正不断累积。尽管仅纳入单一支架设计的试验通常具有更好的内部有效性,其外部有效性可能受限;然而,多项试验(包括纳入接受任一二代 DES 的患者所开展者)呈现出一致趋势,支持这些结论具有更广泛的适用性。
尤值得关注的是:PCI 术后 1–3 个月将阿司匹林+替格瑞洛降阶为替格瑞洛单药的策略,已在多项随机对照试验(RCT)中得到检验(见表4)。按药效动力学相互作用的推断,这一策略相较持续双药,出血发生率一贯更低;但需结合其对缺血结局的影响综合评估。尽管单项试验在心血管事件方面普遍统计效能不足,目前并无明确“缺血代价”信号,包括支架血栓风险未见上升。对此类试验的荟萃分析可提供进一步洞见。最新发表的 SIDNEY-4 个体数据荟萃分析纳入 6 项试验按方案人群(per-protocol)共 23,256 例:与持续 DAPT 相比,替格瑞洛单药在 MACE 上达到不劣效(HR 0.91,95%CI 0.78–1.07;非劣效性 p=0.0039),BARC 3/5 级出血显著更少(HR 0.43,0.34–0.54;优效性 p<0.0001),且全因死亡呈改善信号(HR 0.76,0.59–0.98;优效性 p=0.034);试验序贯分析支持上述结果。此前的 SIDNEY-3 显示:从 DAPT 早期降阶至氯吡格雷虽可减少出血,但预防缺血事件不及持续 DAPT;相对之下,降阶至替格瑞洛既减少出血,又在预防缺血事件方面不劣效,并在降低净不良临床事件上具优势。
表4 随机对照试验:持续 DAPT 对比早期降阶至替格瑞洛单药于 PCI 人群
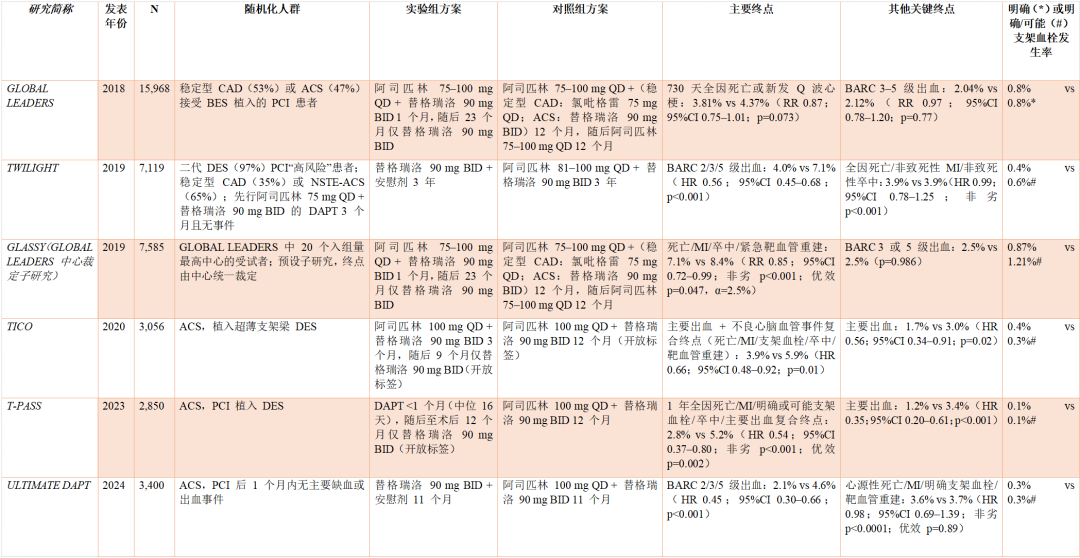
缩略语:ACS=急性冠状动脉综合征;BARC=出血学术研究联盟;BID=每日两次;BES=Biolimus A9 洗脱支架;CAD=冠状动脉疾病;DAPT=双联抗血小板治疗;DES=药物洗脱支架;MI=心肌梗死;OD/QD=每日一次;PCI=经皮冠状动脉介入治疗。
反之,亦有部分人群可能持续从延长 DAPT中获益,尤其在非靶病变相关的动脉粥样硬化性血栓事件风险很高而出血风险不高时。此点对多支冠状动脉病(multivessel CAD)且合并不可改变或仅部分可改变的动脉粥样硬化性血栓危险因素者尤为相关。由此提示:当危险因素无法通过其他药物学干预充分控制且出血风险不高时,强化抗血小板治疗可能更为有利。鉴于上述不可改变的缺血风险不会随时间消退,部分病例长期维持 DAPT在逻辑上是合理的;但一旦发生出血,或出血风险谱发生变化,应及时复评并调整策略。
因此,我们或许正迈入双轨策略的阶段:对于以预防支架血栓为抗栓首要目标、且存在高出血风险的患者,宜采用短期 DAPT,随后改为可靠的 P2Y12 受体抑制剂单药,并同步强化可修饰危险因素的管理。相对地,多支冠脉病变且合并不可修饰的血栓危险因素、而出血风险较低的患者,可能更适合延长 DAPT。
PCI及相关抗血栓治疗的未来关键问题
我们能否在PCI过程中更少使用支架?
近年来,“leave nothing behind”策略的PCI重新受到关注。当前PCI的默认技术在很大程度上已成为病变预处理、植入一枚或多枚药物洗脱支架(DES)并行后扩张;单纯球囊成形(balloon angioplasty)通常仅保留用于血管过小而无法植入支架的情况。然而,另一种做法是在最佳病变预处理后使用涂布抗增殖药物的球囊(药物涂层球囊,DCB),将药物转移至病变的管腔表面。其优势在于:在扩张并治疗病变的同时,促进更为生理性的重塑并获得晚期管腔增益,保留血管的天然柔顺性,并且不存在支架血栓风险。其劣势包括促使支架最初被引入的一些问题,即回缩以及夹层并血管闭塞的风险,不过关键差异在于,如有需要可选择以支架植入进行补救。对于需要更大径向支撑的复杂病变,差结果的风险可能更为显著。药物递送的持续性也不如植入DES时那样持久,且目前部分DCB仍使用紫杉烷类药物,而在DES中,紫杉烷类药物先前被证实较“莫司”类药物关联更差的结局。
尽管 DCB 问世已有时日,其应用总体多集中于支架内再狭窄(ISR)或小血管病变,作为 POBA 的替代选择。近年,作为大血管新发病变(de novo lesions)中 DES 的替代方案,DCB 受到更多关注,并已开始在较大规模、以临床结局为导向的试验中接受检验。首个公布的大型试验 REC-CAGEFREE I 的结果令人失望:DCB 治疗在靶病变血运重建方面未达到非劣效标准。其他试验(如 SELUTION DeNovo)有望提供更多见解。DCB 在复杂 PCI中的定位仍待观察,但相关研究正在进行中。例如,HYBRID DEB 试验正在探索分叉病变中主支植入 DES、侧支使用 DCB的策略,并与标准治疗策略——两支架 provisional DES 植入进行比较。
采用DCB 而非 DES时不存在支架血栓风险,因此在无其他指征下,当前建议术后 DAPT 仅 4 周。然而,如前所述,若 DES 术后趋向更早降阶 DAPT,则这一差异可能不再显著。尽管避免了支架血栓,但使用 DCB 而非 DES 可使不稳定斑块未被覆盖,理论上可能增加靶病变相关事件风险;不过已有研究显示,DCB 术后早期即出现血管重塑。正在进行的 REC-CAGEFREE II 试验正评估 DCB 人群缩短 DAPT 的策略,或将带来更多见解。
另一种曾被寄予厚望的策略是生物可吸收血管支架(bioresorbable vascular scaffold,BVS)。其本质为一种可降解支架:在血管重塑期间提供机械支撑,随后被机体吸收,以期远期形成更为生理的血管壁结构——这一构想颇具吸引力。遗憾的是,迄今测试的装置表现不尽如人意:因需较当前代 DES 更厚的支架梁且吸收时间过长,导致晚期与极晚期血栓发生率不可接受,故目前不予推荐。不过,该领域研究仍在推进,BVS 的设计能否经改良而降低上述风险并最终进入临床实践,尚待观察。
DAPT最短可缩至何时?
鉴于支架与药物技术的进步,以及越来越多证据显示在多数情况下 DAPT 短至 1 个月似乎安全,我们有理由追问:许多 PCI 后是否仍需多于一种抗栓药物?目前唯一在 PCI 后即刻尝试单用 P2Y12 抑制剂的大型研究为 STOPDAPT3:将 6,002 例植入 Xience DES 的 ACS 或高出血风险患者,随机分配为普拉格雷单药或阿司匹林+普拉格雷,评估 1 个月结局。结果显示,普拉格雷单药在预防心血管死亡、心肌梗死、确切支架血栓或缺血性卒中方面对 DAPT 不劣效(HR 1.12,95%CI 0.87–1.45;非劣效性 p=0.01),但在 BARC 3/5 级出血上无优效证据(HR 0.95,95%CI 0.75–1.20;优效性 p=0.66);更关键的是,亚急性确切或可能支架血栓在单药组更高(0.58% vs 0.17%;HR 3.40,95%CI 1.26–9.23),即便几乎全部病例均采用了冠脉内成像以优化支架植入。两组普拉格雷方案均为20 mg 负荷+3.75 mg 每日维持;该剂量虽在部分地区作为 DAPT 组成使用,但难以提供高水平 P2Y12 抑制,尚不清楚更可靠的 P2Y12 抑制方案是否会表现更好。正在进行的 LEGACY(NCT05125276) 与 NEOMINDSET(NCT04360720) 有望带来进一步见解。
在 ACS 行 PCI 后、处于替格瑞洛或普拉格雷联合治疗(DAPT)期间的降阶,另一种策略是将 P2Y12 受体抑制剂改为氯吡格雷。该策略可分为两种:其一为“引导型(guided)”——先确认患者不携带与氯吡格雷活性代谢不良相关的 CYP2C19 基因型;其二为**“非引导型(unguided)”——不进行上述检测。以引导型为例,POPULAR GENETICS 试验已对其进行检验,结果显示缺血事件发生率不劣且出血较少**,并且该做法在真实世界中亦被证明可行。未来研究可考虑比较两种降阶路径:基因型引导降阶至阿司匹林+氯吡格雷,与降阶至替格瑞洛单药。在比较二者时,除出血不良反应外,还应注意:替格瑞洛可在相当比例患者中引起呼吸困难,其机制很可能与其在肺部 C 纤维上的 P2Y12 受体 可逆结合有关。该现象本身无害,且在持续给药过程中常可自行缓解,但可能导致提前停药,从而影响替格瑞洛的总体疗效。相对地,与其他 DAPT 或单药方案相比,替格瑞洛单药还有一个优势:特异性逆转剂 bentracimab 正在研发中。关于降阶(及升级)策略的更详尽讨论,可参阅近期学术联盟的共识文件。
长期抗血小板单药应选阿司匹林还是 P2Y12 抑制剂?
近期荟萃分析提示:在既往确诊 CAD 的人群中,用 P2Y12 抑制剂单药进行长期二级预防,较阿司匹林单药可能更有优势,且出血率相近;这一发现亦见于既往行 PCI 的患者(CV 死亡、MI 或卒中的 HR=0.70,95%CI 0.56–0.86)。不过,最新的 STOPDAPT-3 1 年随访(比较 PCI 后第 30 天至 1 年阿司匹林 vs 氯吡格雷单药)并未支持该结论(CV 死亡、MI、确切支架血栓或缺血性卒中 HR=1.00,95%CI 0.77–1.30)。从策略层面看,若在不增出血前提下降低缺血事件得到证实,转向 P2Y12 单药具合理性;但其潜在影响包括:成本更高;若采用未经基因型引导的氯吡格雷,则在治疗中的血小板反应性可变;若采用替格瑞洛,则耐受性可能较差。现行指南已依据不同情境对阿司匹林、氯吡格雷或替格瑞洛单药提出建议(见表 3);至于未来指南是否会更强调长期 P2Y12 抑制剂单药,尚待观察。
结论
冠状动脉支架植入的 PCI 仍然是 CAD 管理中的重要组成部分。目前,对接受 PCI 的患者,默认推荐的抗血小板策略为:ACS 病例使用阿司匹林+普拉格雷/替格瑞洛的 DAPT 12 个月;CCS 病例使用阿司匹林+氯吡格雷的 DAPT 6 个月。然而,支架设计与植入技术的持续演进已显著改善结局,其中包括降低支架血栓风险。与此相结合,其他方面的进步——例如更好地控制可修饰的动脉粥样硬化性血栓危险因素以及更为可靠的 P2Y12 受体抑制剂的可用——意味着可以更早进行抗血小板治疗降阶(如由 DAPT 转为单药治疗,尤以替格瑞洛单药),其带来更少出血,且在许多人群中似乎并未付出显著的缺血性代价。对于缺血风险尤其高而并非高出血风险的患者——特别是动脉粥样硬化性血栓危险因素不可修饰者——延长、较高强度的抗血栓治疗依然合乎逻辑。展望未来,PCI 的图景可能包括对支架依赖的进一步降低,以及 DAPT 疗程的进一步缩短。