
2025年9月27日,2025成都国际心脏瓣膜病介入治疗会议(PCRCCV 2025)举行专题论坛“功能性二尖瓣反流的最佳管理策略(Optimal Management of Functional Mitral Regurgitation)”。本场论坛由英国伦敦克利夫兰诊所的Bernard Prendergast教授与爱尔兰国立大学(高威)William Wijns教授联合主持,来自中国、欧洲、加拿大及亚洲的多位专家学者——包括中国科学院院士、复旦大学附属中山医院葛均波教授,中国科学院院士、浙江大学医学院附属第二医院王建安教授,首都医科大学附属北京安贞医院马长生教授,加拿大麦吉尔大学医学中心Nicolo Piazza教授,围绕功能性二尖瓣反流(FMR)的分型管理、治疗选择及未来方向展开了深入探讨。

研讨背景与临床意义
▼▼▼
功能性二尖瓣反流作为心力衰竭患者的重要并发症,其发病率随人口老龄化持续上升。在美国,二尖瓣反流是最常见的心脏瓣膜疾病之一,而功能性二尖瓣反流在结构正常的瓣叶组织中发生,主要由左心室或左心房重构引起。近年来,随着对FMR病理生理机制认识的深化,临床界逐渐认识到这并非单一疾病实体,而是一组具有不同发病机制、临床表现和治疗反应的异质性疾病谱。
2022年发表的一项重要研究首次系统提出了房性功能性二尖瓣反流(AF-MR)的概念,将其与传统的心室性功能性二尖瓣反流(VF-MR)区分开来(Farhan et al., 2022)。房性功能性二尖瓣反流主要与左心房扩大和二尖瓣环扩张相关,在心房颤动和射血分数保留的心力衰竭(HFpEF)患者中尤为常见。这一认识的突破性意义在于,它提示我们需要针对不同病因采取差异化的治疗策略。
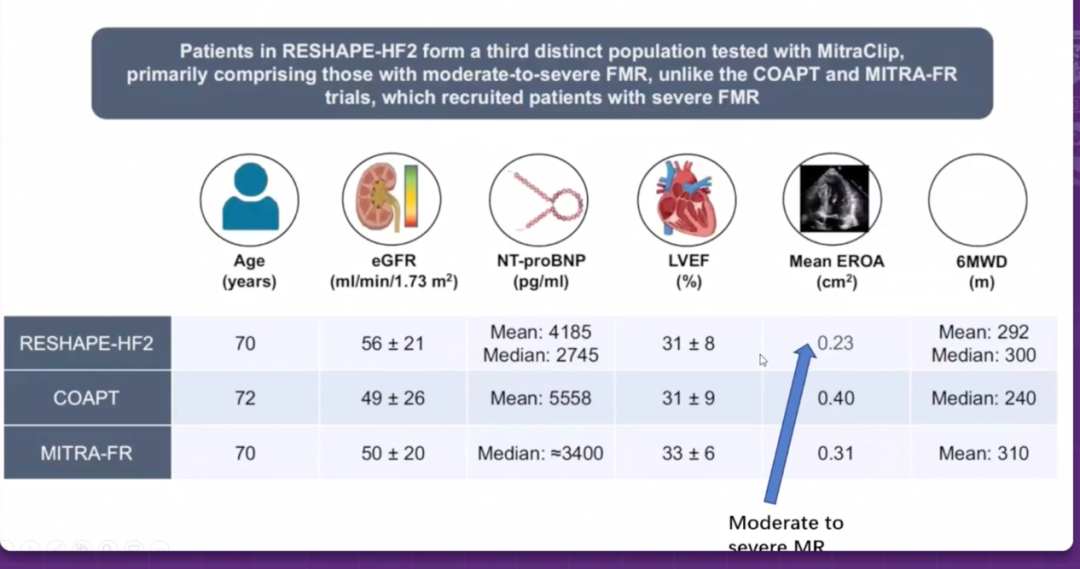
更为重要的是,COAPT和MITRA-FR两项关于经导管二尖瓣缘对缘修复(M-TEER)的随机对照试验结果相互矛盾,促使临床界重新审视FMR的异质性。COAPT试验显示M-TEER显著改善患者预后,而MITRA-FR试验未能证实这一获益。深入分析发现,两项试验入组患者的病理生理特征存在根本差异:COAPT试验中患者的反流程度相对于左室扩张呈"不成比例"状态(左室舒张末容积192 mL,有效反流口面积0.41cm²),而MITRA-FR患者则表现为"成比例"甚至"低比例"反流(左室舒张末容积252mL,有效反流口面积0.31cm²)。
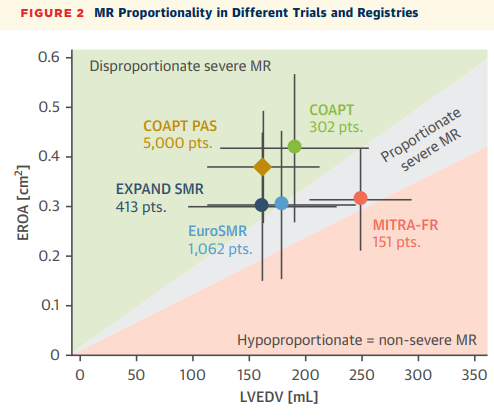
这些发现的临床意义深远:它们不仅解释了为何同一治疗手段在不同患者群体中疗效迥异,更提示我们需要建立基于病理生理分型的精准治疗体系。正是在这样的学术背景下,本次论坛汇聚国际顶尖专家,从指南解读、房颤消融、复杂病变处理到新技术应用等多个维度,系统探讨FMR的最佳管理策略,具有重要的理论价值和实践指导意义。
01
从指南出发:FMR管理的循证新格局
功能性二尖瓣反流的最佳管理策略:解读最新 ESC/EACTS 指南
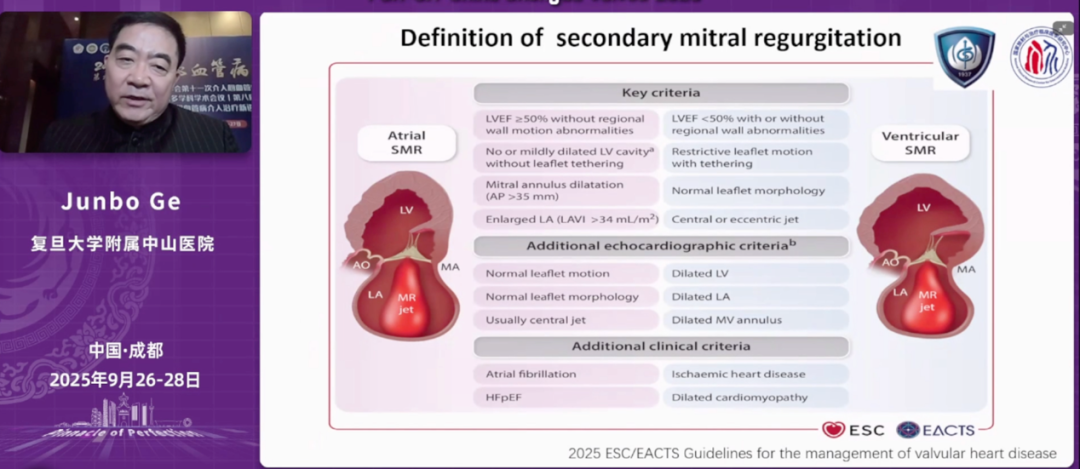
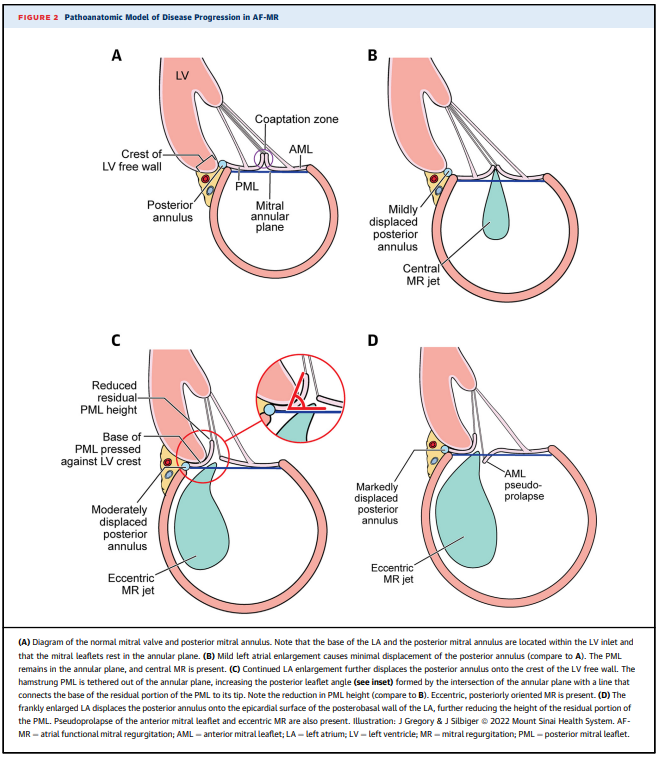
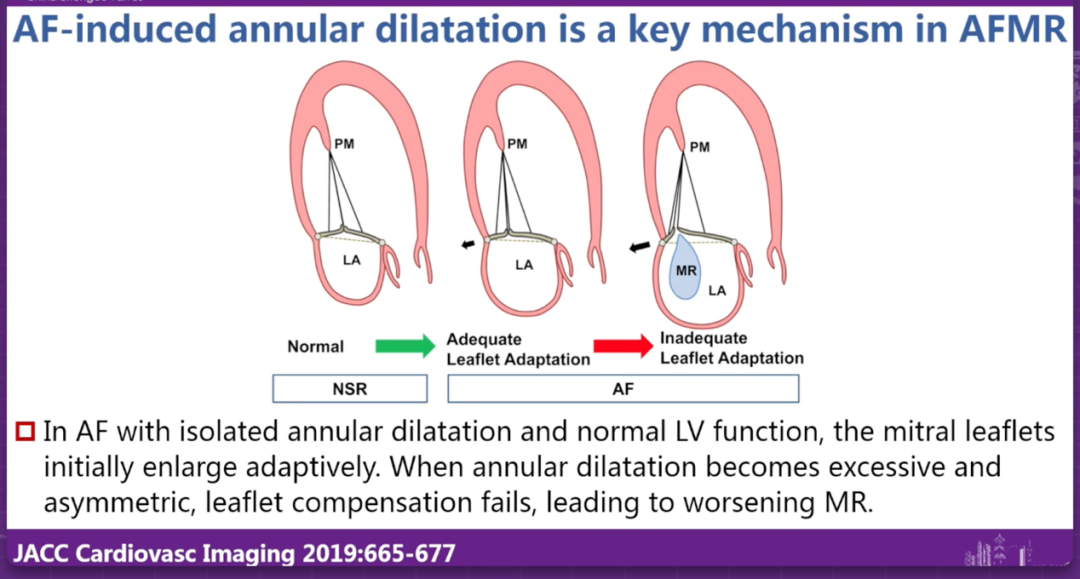
葛均波教授从2025年最新版欧洲心脏病学会/心胸外科学会(ESC/EACTS)指南出发,系统阐述了功能性二尖瓣反流管理策略的更新要点。他指出,指南首次将房性功能性二尖瓣反流(AFMR)独立分类,与心室性二尖瓣反流(VFMR)区分开来,这标志着临床对FMR病理机制认识的进一步深化。AFMR主要源于心房扩张和瓣环形态改变,表现为正常的左室大小和射血分数但伴有明显的左心房扩大;而VFMR则与左室重构和乳头肌牵拉相关,通常发生在射血分数降低的心力衰竭患者中。
房性功能性二尖瓣反流的机制与所谓的"房源性瓣叶牵拉"(atriogenic leaflet tethering, ALT)密切相关:当左心房和后瓣环扩大时,这些结构从心室入口"突出",导致瓣环向左室游离壁顶部移位。移位的瓣环向上(基底方向)牵拉后瓣叶,而收缩的乳头肌同时向下(心尖方向)牵拉瓣叶,形成牵拉效应,减少其参与对合的能力。这种独特的病理机制解释了为何AFMR患者在解剖学和血流动力学上与VFMR存在本质差异。两者在病理基础、治疗目标和预后判断上均存在显著差异。
在治疗策略上,葛均波教授强调应根据反流机制、左室大小、瓣环结构及合并症情况,合理选择TEER或外科手术。他指出,TEER的应用范围已从传统器质性病变扩展至功能性反流患者,尤其是药物治疗充分但症状仍明显的患者。

他深入分析了COAPT试验与MITRA-FR试验的分歧根源。COAPT试验采用多参数方法定义重度继发性二尖瓣反流,而MITRA-FR研究按照欧洲指南,将有效反流口面积>0.2cm²视为重度反流。更关键的是,MITRA-FR允许纳入左室射血分数更低和左室明显扩张的患者,且未排除严重右室功能不全的患者。葛教授引入了"比例性"概念来理解治疗反应的差异。比例性二尖瓣反流是指反流程度与严重左室扩张成比例,被认为是全面均匀左室功能障碍和扩张的结果,伴有对称性二尖瓣解剖改变。这些患者可能更有可能从指南导向药物治疗(GDMT)的优化中获益,因为左室有逆向重构的潜力。相反,不成比例的二尖瓣反流患者通常表现为更严重的反流和较轻的左室扩张(例如由于心肌梗死后不对称牵拉或心脏不同步),对GDMT的反应可能较差。
葛均波教授总结道,功能性二尖瓣反流的管理正逐渐由单纯结构矫正向病因分型和精准干预转变。未来的重点在于更全面的影像学评估、病理分层及多学科团队决策。
02
房性功能性二尖瓣反流的最佳管理策略:房颤消融的价值

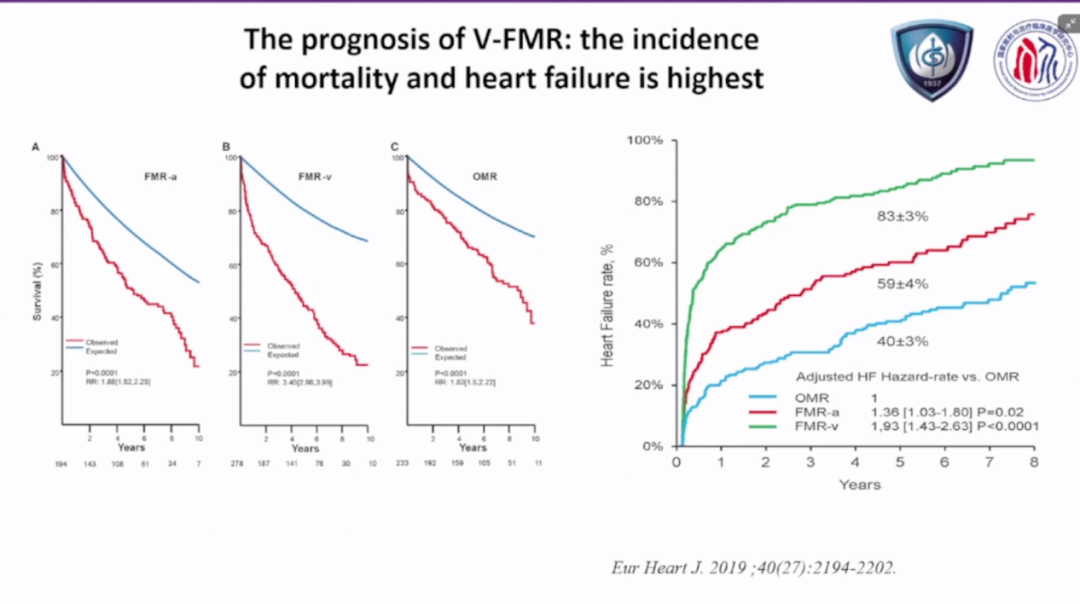
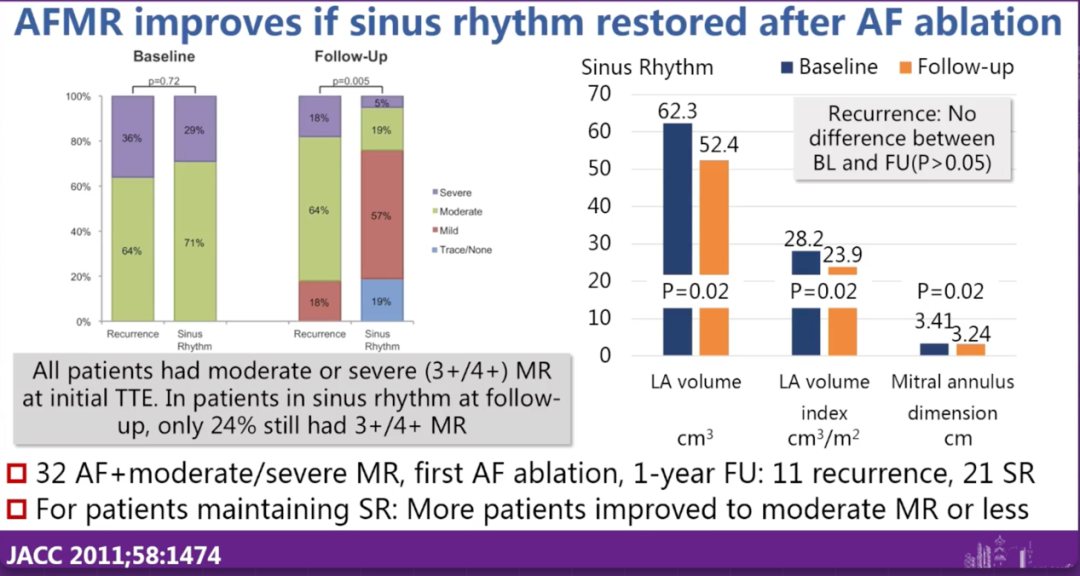
马长生教授围绕房性功能性二尖瓣反流(AFMR)的治疗策略进行了深入讲解,重点分析了房颤消融在改善反流程度中的作用和机制。他指出,AFMR的主要发病机制是长期房颤导致的左心房扩大和瓣环扩张,造成瓣叶对合不全,但瓣叶结构多为正常。因此,这类反流具有可逆性。
结合大量临床研究和安贞医院的随访经验,马长生教授指出,在成功恢复窦律的AFMR患者中,绝大多数可观察到二尖瓣反流程度明显下降,部分患者甚至可恢复至无反流状态。他认为,房颤消融通过改善房室几何关系,实现了从节律层面到结构层面的双重重构。
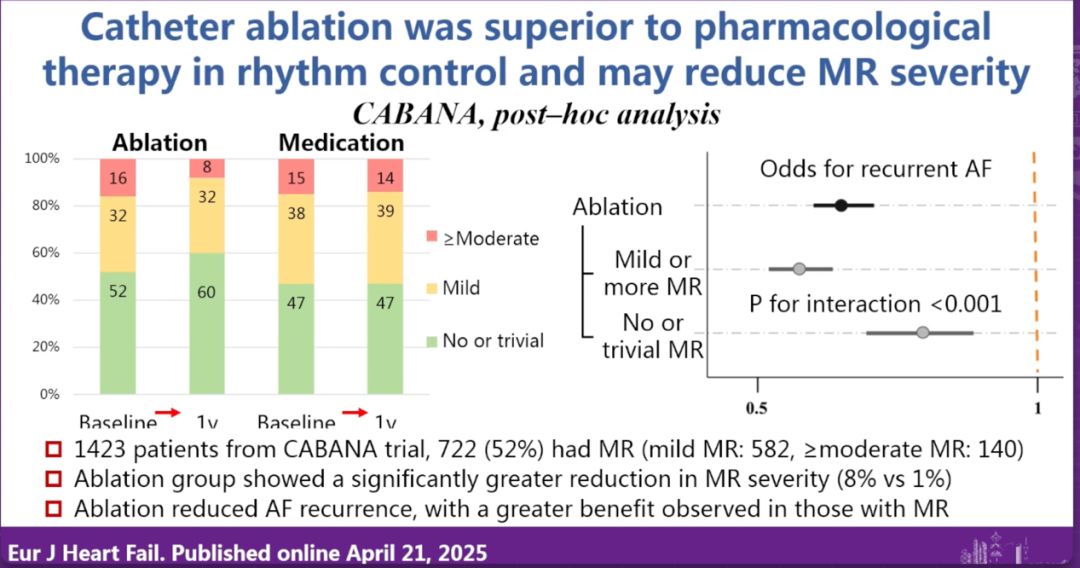
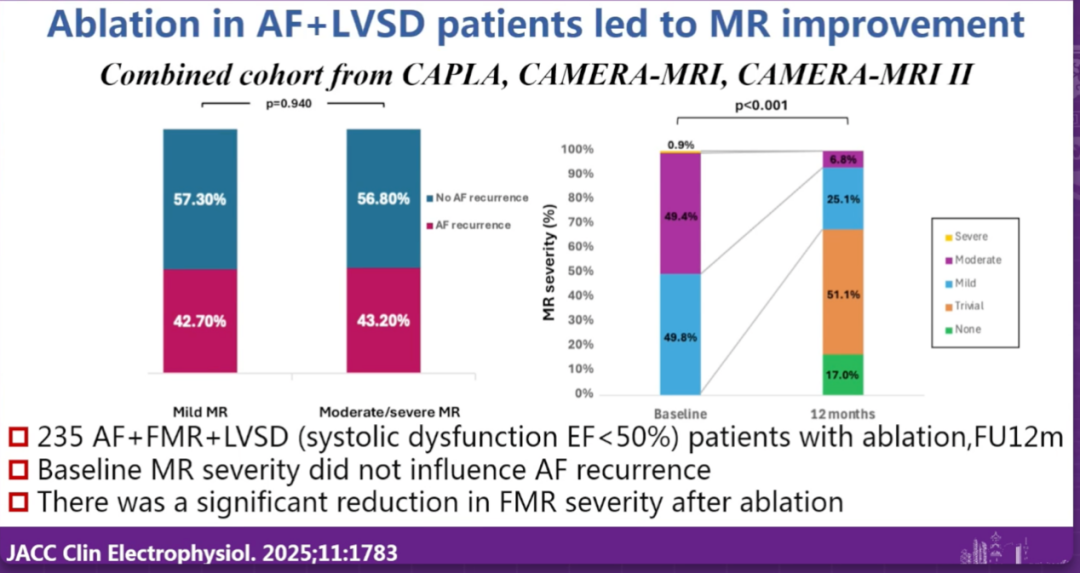
在讨论环节中,他特别强调,若患者已出现明显瓣叶脱垂,则TEER更为合适;而在以瓣环扩张为主的AFMR病例中,可尝试先行房颤消融并随访MR改善。他建议,临床可通过三维超声或CT等影像学参数评估瓣环扩张程度和左房体积变化,从而预测消融后的反流改善情况。
马长生教授总结,AFMR的成功管理应以早期干预和心律控制为核心,目标不仅是恢复窦律,更是实现房室结构与瓣膜功能的整体逆转。
03
房性二、三尖瓣反流并存:我会如何处理?

王建安教授的报告聚焦于房性二尖瓣反流与三尖瓣反流共存的复杂情况,这代表了临床实践中最具挑战性的场景之一。中至重度三尖瓣反流在接受二尖瓣手术或经导管干预的患者中约占三分之一。尽管历史上被认为是良性疾病,但三尖瓣反流已被证实对预后和生活质量有负面影响。在一项大型英国登记研究中,合并二尖瓣和三尖瓣反流的长期生存率相比单独的二尖瓣或三尖瓣反流更差。这类患者常伴长期房颤和双心房扩张,其反流机制主要是瓣环几何改变与心腔结构重塑的结果,表现出典型的“心房型瓣膜病”特征。
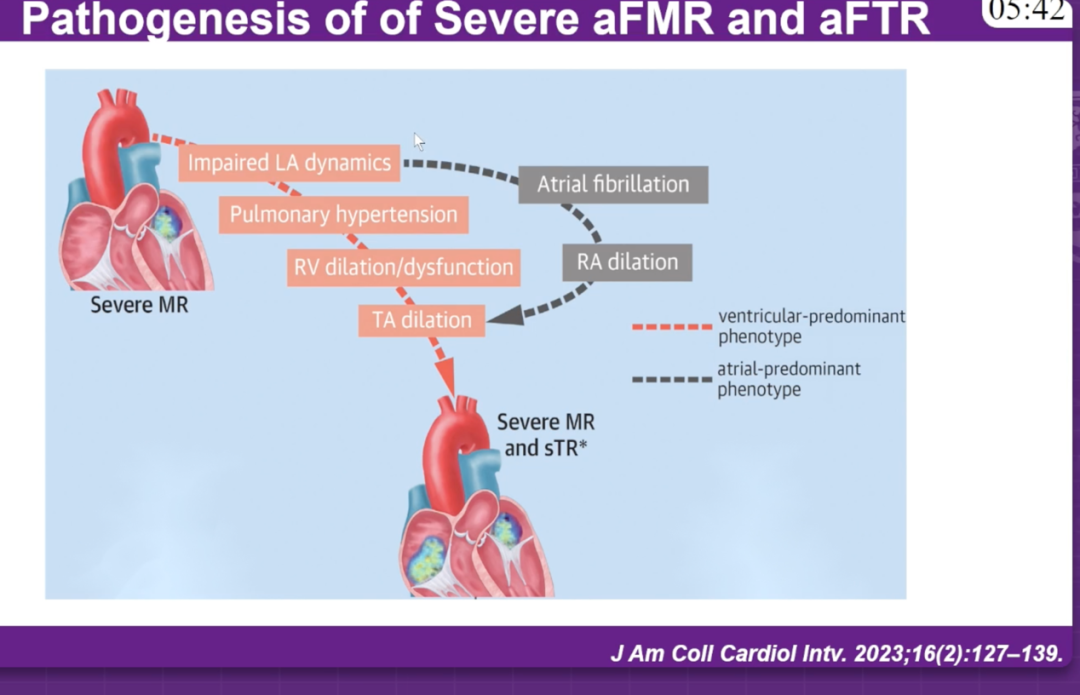
王建安教授从"我会如何处理(How would I treat)"的实践角度,系统阐述了应对这类复杂病变的三大治疗策略:
1、病因导向的基础治疗(Etiology-based treatment)
针对不同的基础疾病采用相应的治疗措施。对于心力衰竭伴射血分数保留(HFpEF)患者,采用利尿剂、SGLT2i及合并症管理;对于高血压患者进行血压控制;对于房颤患者,可选择导管消融或药物/电复律进行节律控制。
2、序贯干预策略(Sequential intervention)
根据患者具体情况选择不同的干预顺序:
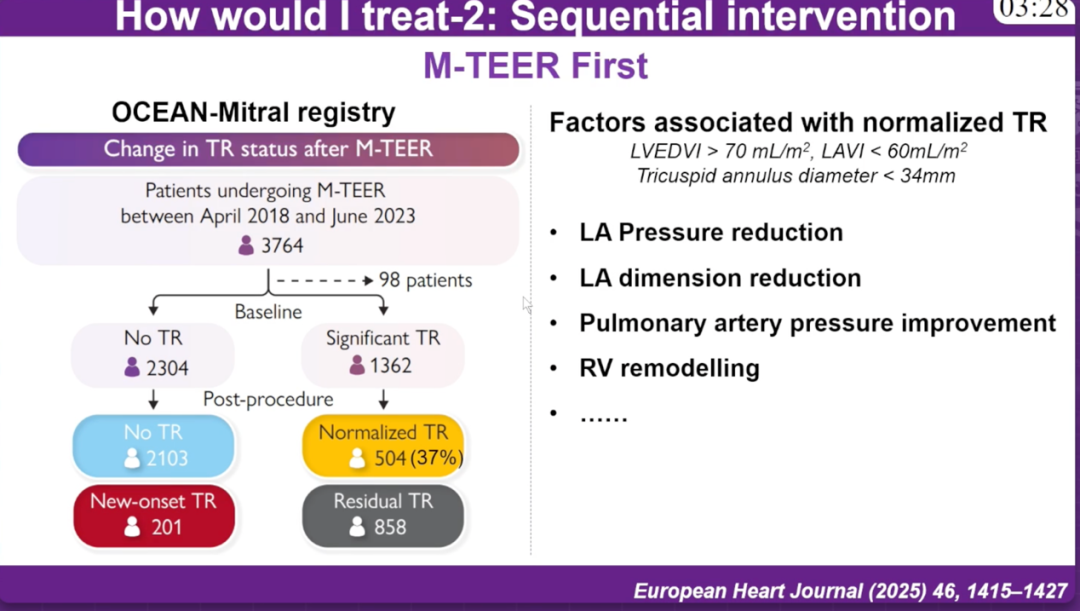
二尖瓣优先策略(M-TEER First):基于OCEAN-Mitral注册研究数据,在3764例接受M-TEER治疗的患者中,37%(504例)的患者三尖瓣反流改善。与三尖瓣反流改善相关的因素包括:LVEDVI>70mL/m²、LAVI<60mL/m²、三尖瓣环直径<34mm,以及左房压力降低、左房尺寸缩小、肺动脉压力改善和右室重构等。这一策略的理论基础在于,通过纠正二尖瓣反流,可以降低左心房压力,进而减轻肺动脉高压和右室压力负荷,使部分患者的三尖瓣反流自行改善。
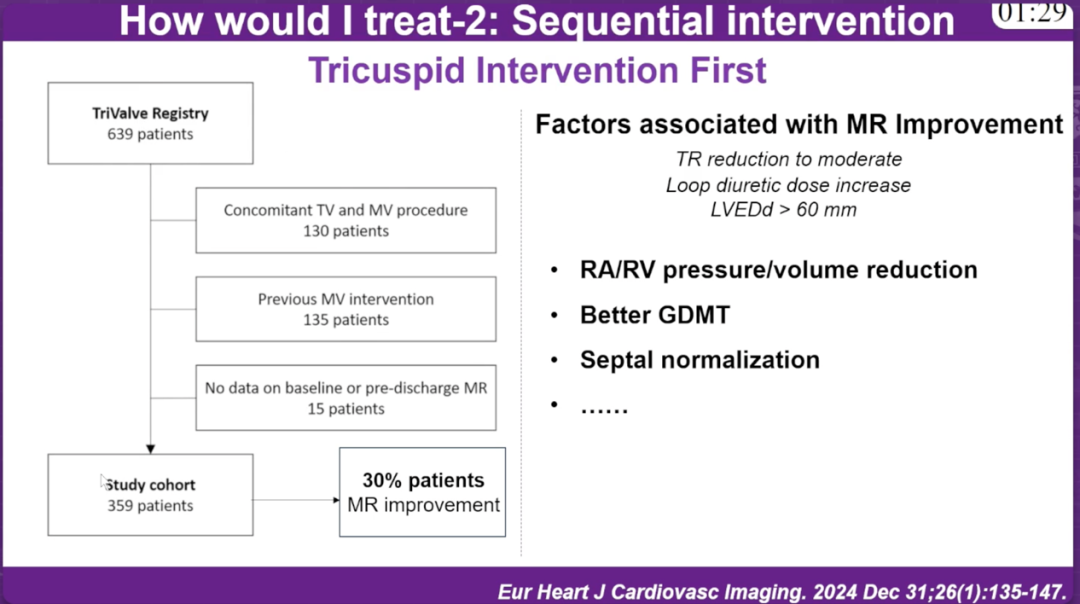
三尖瓣优先策略(Tricuspid Intervention First):基于TriValve注册研究的639例患者数据,在359例研究队列中,30%的患者二尖瓣反流得到改善。与二尖瓣反流改善相关的因素包括三尖瓣反流减至中度、利尿剂剂量增加、LVEDd > 60mm,以及右房/右室压力/容量减少、更好的GDMT和室间隔正常化等。
3、同期联合干预(Concomitant intervention)
对于适合同期干预的患者,需要满足以下条件:无法维持窦性心律、明显的双心房扩大、两个瓣膜都具有适合干预的解剖结构。这种策略适用于严重的房性二尖瓣反流/房性三尖瓣反流患者。同期干预的策略包括M-TEER/T-TEER + 瓣环成型、TMVR/TTVR + 瓣环成型、M-TEER + TTVR 或者TMVR+ T-TEER。
王建安教授最后强调,通过循证医学数据支持的治疗决策,能够为不同患者选择最适合的治疗时机和方式,实现个体化精准治疗。无论采用哪种策略,都应基于患者的具体病理生理特点和解剖条件,以获得最佳的临床效果。
04
功能性二尖瓣反流TMVR:现状与未来展望

Nicolo Piazza教授系统介绍了经导管二尖瓣置换术(TMVR)在FMR治疗中的最新进展。他首先明确了TEER的适应证限制,指出以下情况为"不良"的二尖瓣TEER候选者:瓣口面积小(无钙化时<3cm²,有钙化时<4cm²)、后叶长度过短(<4-5mm)、瓣叶抓取区域钙化、瓣叶厚度>5mm,以及AFMR伴对合间隙>4mm。对于这些复杂病变,TMVR提供了更具适应性的治疗选择。
Piazza教授展示了TMVR技术的快速发展轨迹。从2012年至2023年,多种装置相继问世,包括Tendyne、Intrepid、M3、Highlife等系统,形成了丰富的技术谱系。

TMVR能够实现近乎完全的二尖瓣反流消除
Tendyne装置:能够提供持久的反流减轻效果,但需要经心尖途径
Intrepid/M3/Highlife装置:经股途径可行,早期结果令人鼓舞
仍存在的挑战:包括抗凝需求、左室流出道梗阻风险,以及死亡率主要由合并症驱动
30天全因死亡率0.0%,1年全因死亡率6.7%
30天卒中发生率0.0%,1年为0.0%
1年心血管住院率22.3%
二尖瓣反流显著改善:基线时81%的患者为重度反流,1年时96%的患者达到无/微量反流
Piazza教授表示,TMVR技术的快速发展不仅拓展了FMR的治疗边界,更重要的是为那些不适合TEER治疗的复杂解剖患者提供了有效的治疗选择。他强调多种装置(M3、Intrepid、Tendyne、Highlife)显示出强有力的手术成功率,患者选择和影像学评估仍然至关重要。
展望未来,他指出技术发展的方向将是:经股途径、更简单的操作流程、更耐久的瓣膜材料,以及更精准的患者选择标准。TMVR将与TEER共同构建功能性二尖瓣反流的完整介入治疗体系,实现对不同复杂程度病变的全覆盖。他特别强调,TMVR不是要取代TEER,而是作为互补技术,使得更多原本无法接受介入治疗的患者获得治疗机会。
总结
▼▼▼
论坛最后,Bernard Prendergast教授对整场会议进行了总结。他指出,功能性二尖瓣反流的治疗正经历从病因分型到精准融合的变革。房颤消融、TEER与TMVR等治疗手段并非相互竞争,而是共同构建了以节律控制、结构修复和功能改善为核心的综合管理体系。他强调,未来应进一步加强影像学评估在患者筛选与疗效预测中的作用,推动多学科协作的常规化与标准化。FMR的最佳管理策略将不仅依赖技术进步,更需要长期的随访与全病程管理理念。
