以下文章来源于血管资讯 ,作者宋超、李振江
现有的台架试验和临床经验显示生物瓣膜扩裂技术(Bioprosthetic valve fracture, BVF)可以明显提高瓣中瓣介入瓣膜植入(VIV-TAVR)后的有效开口面积,降低跨瓣压差,是一项可行安全有效的技术。
——摘自文章章节
【Ref: John T Saxon, et al. Interv Cardiol. 2018 Jan;13(1):20-26. doi: 10.15420/icr.2017:29:1.】
背景和目的
对于外科生物瓣(BPVs)衰败后再次外科手术风险较高的患者,瓣中瓣经导管植入瓣膜(Valve-in-valve transcatheter aortic valve replacement, VIV-TAVR)是一种安全有效的治疗方法。但接受VIV-TAVR的患者存在患者-瓣膜不匹配(PPM)的风险,因为经导管心脏瓣膜(THV)被植入原有BPV内,原有瓣环限制了THV的完全扩张并降低了THV的最大有效瓣口面积。而PPM和较高的残余跨瓣压差与VIV-TAVR术后生存率降低有关。生物瓣膜扩裂技术(Bioprosthetic valve fracture, BVF)是解决这一问题的新技术,即采用非顺应性瓣膜成形球囊在BPV骨架内进行高压扩张,以使BPV的手术缝合环断裂,可使BPV和植入的THV进一步扩张,从而增加VIV-TAVR后的最大有效瓣口面积。来自美国密苏里大学堪萨斯分校心脏研究所的John T Saxon教授及其团队就BVF技术优化VIV-TAVR的相关文献进行综述,包括初始试验、技术步骤、临床研究和未来发展方向等。相关结果发表于国际权威杂志Journal of Interventional Cardiology。
台架试验
目前已有两个系列研究对非顺应性瓣膜成形球囊高压扩张BPVs的测试结果进行报道,包含了市售可获得的大部分BPVs(Trifecta (St Jude, Minneapolis, MN, USA), Mitroflow (Sorin, Milan, Italy), Magna Ease (Edwards Lifesciences, Irvine, CA, USA), Mosaic (Medtronic), Magna (Edwards Lifesciences), Hancock II (Medtronic) and Biocor Epic (St Jude) valves),所采用球囊为Atlas Gold (Bard, Tempe, AZ, USA) and True Balloons (Bard)。图1为高压球扩生物瓣膜扩裂技术。

图1
表1汇总了两个系列研究的测试结果。除Hancock II瓣膜、Trifecta瓣膜外的瓣膜均可扩裂(图2)。在两个研究中Hancock II瓣膜、19 mm Trifecta瓣膜均不能被扩裂,21 mm Trifecta瓣膜仅发生部分扩裂,两个研究均不推荐对Trifecta瓣膜采用BVF技术。带有合金金属带环(Magna和Magna Ease)的BPV比聚合物环的BPV具有更高的断裂阈值。这两个系列研究之间基本一致的结果可以为术者规划BVF手术提供指南。
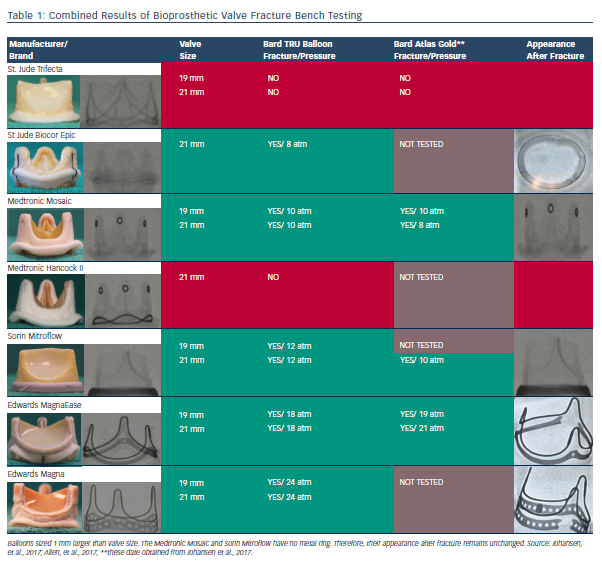
表1
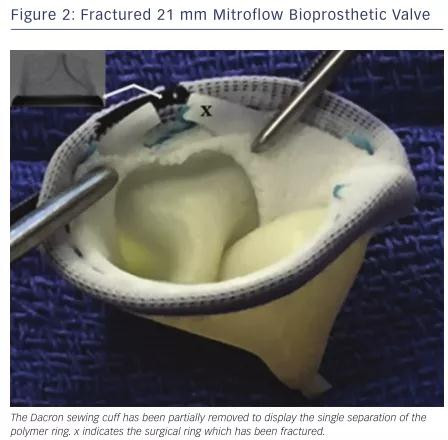
图2
临床经验
目前已有两个相关病例系列报道(两组患者)发表,接受VIV-TAVR+BVF治疗的患者的相关结果如表2所示。30例患者(平均年龄79.0岁)接受VIV-TAVR治疗。15例患者先TAVR后BVF,另15例患者先BVF后TAVR。无围手术期死亡、冠状动脉阻塞、瓣环破裂、主动脉根部损伤、瓣周漏或心包积液。两例围手术期小中风,均完全恢复。总体上两组患者的平均跨瓣压从术前的41 mmHg降低到VIV-TAVR+BVF术后的11 mmHg, EOA从0.75提高到1.7 cm²。其中一组患者,大多数患者(15/20)先行VIV-TAVR后接受BVF治疗。此这部分患者,跨瓣压从术前41.9 mmHg降低到VIV-TAVR后20.5 mmHg,BVF后平均跨瓣压从20.5 mmHg进一步降低到6.7 mmHg。平均EOA分别为0.6、1.0和1.7 cm²。因此,BVF对改善VIV-TAVR手术的获益是显而易见的。
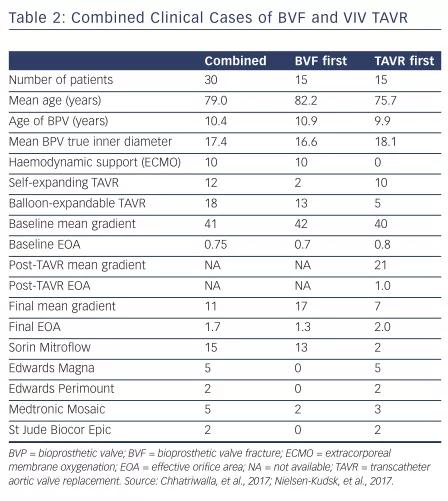
表2
并发症
尽管BVF对VIV-TAVR后血流动力学的获益是显而易见的,但BVF增加额外的并在风险还不完全清楚。已发表的系列报道和未发表的临床经验中,并发症发生率相对较低,但BVF手术仍存在一些理论风险,必须加以考虑。在VIV TAVR术中,THV到冠状动脉口的距离小于3毫米认为冠状动脉闭塞的风险较高。而BVF改变了BPV的结构,使得BPV瓣叶的最终位置无法确定。台架试验显示BVF后BPV直径最大可增加3-4mm。冠状窦中容纳BVF所需的额外空间尚不完全清楚。从VIV-TAVR推荐的安全范围推断,行BVF时,BPV到冠状动脉距离小于5mm可以认为是冠状动脉阻塞的高危因素。目前,还没有报道与BVF相关的冠脉阻塞病例。
瓣膜选择
目前,美国已批准可在VIV-TAVR中使用自膨和球扩THV。一些数据表明,与球扩瓣膜相比,自膨瓣膜在VIV-TAVR中血流动力学获益更多,EOA更大。另有体外试验表明选择较大直径的瓣膜可能产生更好的跨瓣压,然而,这一概念在临床实践中尚未得到严格的验证,并且BVF后TAVR瓣膜扩张与最佳血流动力学之间的相互关系尚还不完全清楚。
瓣膜成形球囊选择
在台架试验和临床实践中,Atlas Gold 和True Dilatation 球囊均可扩裂小型号的BPVs。球囊的尺寸只需大于BPV的内径就可以使瓣膜断裂。此外,目前尚不知道使用较大的瓣膜成形术球囊(尺寸比BPV标称直径大1 mm)能够扩裂大型号BPV(>21mm),大型号瓣膜中球囊所施加的力可能与小瓣膜中球囊所施加的力有所不同,这一点尚未在临床或试验中进行系统测试。
BVF时机
在TAVR之前还是之后进行BVF目前尚无定论。一些术者倾向于在VIV-TAVR之前进行BVF,以避免在高压球囊扩张过程中造成瓣叶的亚临床损伤,这可能会影响THV的长期耐久性。然而球扩THV在术中本身不可避免承受球扩的压力,而采用自膨式THV,则可通过将球囊肩部置于瓣环水平以下避免可能的瓣叶损伤。目前还没有关于BVF后THV耐久性的可靠长期数据。然而一些台架试验数据表明,先行BVF可能存在缺陷:如BVF后植入球扩THV,顺应性的输送球囊不足以完全扩张TAVR瓣膜,存在明显的瓣膜扩张受限,最后仍需高压球囊充分扩张。血流动力学数据也似乎支持先VIV-TAVR后BVF的策略。在目前已发表的病例系列(n=30)中,先VIV-TAVR后BVF的患者最终血流动力学似乎优于先行BVF的患者(表2)。然而这一结果仍需谨慎解释,因为每组患者总数很少,而且结果存在混杂因素。
长期结果
目前有一些关于BVF术后1个月血流动力学耐久性的数据发表。一项研究中18例患者接受先BVF后VIV-TAVR治疗,术前平均跨瓣压和EOA分别为42.8±17.0 mmHg和0.8±0.3cm²,术后分别提高到8.1±3.6mmHg和1.96±0.58cm²。随访1个月时平均跨瓣压和EOA分别为12.7±5.0 mmHg和1.64±0.3cm²,与术后血流动力学测量结果无统计学差异。这些患者的长期随访正在进行中。从瓣膜耐久性来看,BVF通过增加原有BPVs内径,优化THV扩张避免瓣叶折叠和降低跨瓣压,可能会降低瓣叶应力和退化,从而提高THV的长期耐用性。
未来展望
BVF+VIV-TAVR技术的初步台架试验和临床经验为治疗BPV衰败患者的治疗提供可靠的方法。然而,这种新技术的许多相关问题尚未得到解答。BVF是否对VIV-TAVR术后有PPM风险的患者的生存率有影响仍有待观察。需要更多数据来说明与单独VIV-TAVR相比,BVF+VIV-TAVR对患者生活质量的益处。较大型号BPVs(标称瓣膜直径>21mm)的患者中BVF的可行性尚未得到验证,而这是否能改善患者预后也尚不清楚。在有冠状动脉阻塞和主动脉根部损伤风险的患者中进行BVF的安全范围也还需要进一步的研究。
本文由宋超医师审校及组稿 李振江医师编译


转自:血管资讯