肾去交感神经术在心房颤动治疗中的应用
2015-08-11 14:48
心房颤动(房颤)是临床中最常见的心律失常之一,其人群发病率为0.4-1%,并且随着年龄的增长其发病率也随之增加[1]。经皮肾去交感神经导管射频消融术(catheter-based renal sympathetic denervation, RDN)是近年新兴的介入治疗方法,通过局部损伤肾交感神,阻滞传出和传入纤维,从而降低肾脏及全身交感神经活性。最初由Krum等[2]在2009年首次报道用于临床治疗顽固性高血压,随即掀起了医学界对RDN的研究热潮。尽管目前SYMPLICITY HTN-3试验[3]结论为阴性,尚不能在临床中全面推广RDN用于治疗难治性高血压,但亦不能全面否定RDN在心血管病领域内的疗效。
阅读数: 1534
1 肾交感神经系统的病理生理作用
肾脏不仅是交感神经激活的靶器官,同时也是交感神经激活来源的重要感受器。可见肾交感神经系统不是一个孤立的系统,它是和中枢及周围相关器官相关联的一个部分共同参与机体的调节。肾交感神经由传入神经和传出神经组成,二者在解剖上均位于肾动脉外膜的浅表部位。肾传人神经主要发源于肾孟管壁,沿肾动脉传出,并扩展到同侧的背根神经节,投射到脑干、下丘脑,进而调控心脏、肾脏和外周血管的活动。肾传出神经主要发源于心血管交感中枢功能区,经胸段和腰段发出节前神经元轴突,到达椎前和椎旁交感神经节,再发出节后神经纤维沿着肾动脉进入肾门区,此后分成小束穿透小血管并进入其附近的近髓肾单位[4]。肾交感神经传出纤维活性的增加可促进肾素的分泌,进而激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS);此外还可造成肾血管收缩、肾小管重吸收增加,进而引起水钠潴留,肾脏血流量较少等生理变化。而肾交感神经传入纤维将所携带的肾化学感受器和机械感受器的信息投射到脊髓及脊髓以上水平中枢神经系统。肾交感传入神经激活是中枢交感神经过度激活的重要原因之一,同时中枢交感神经激活又进一步增高肾脏交感传入神经的活性,因此二者存在密切的相互联系。
RDN是将导管经股动脉路径送达肾动脉,在选定的位置释放射频电流,使肾动脉内膜局部产生高温并传导到外膜,位于肾动脉外膜中的交感神经纤维在高温下变性坏死,从而部分阻断肾交感神经的活性。
肾脏不仅是交感神经激活的靶器官,同时也是交感神经激活来源的重要感受器。可见肾交感神经系统不是一个孤立的系统,它是和中枢及周围相关器官相关联的一个部分共同参与机体的调节。肾交感神经由传入神经和传出神经组成,二者在解剖上均位于肾动脉外膜的浅表部位。肾传人神经主要发源于肾孟管壁,沿肾动脉传出,并扩展到同侧的背根神经节,投射到脑干、下丘脑,进而调控心脏、肾脏和外周血管的活动。肾传出神经主要发源于心血管交感中枢功能区,经胸段和腰段发出节前神经元轴突,到达椎前和椎旁交感神经节,再发出节后神经纤维沿着肾动脉进入肾门区,此后分成小束穿透小血管并进入其附近的近髓肾单位[4]。肾交感神经传出纤维活性的增加可促进肾素的分泌,进而激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS);此外还可造成肾血管收缩、肾小管重吸收增加,进而引起水钠潴留,肾脏血流量较少等生理变化。而肾交感神经传入纤维将所携带的肾化学感受器和机械感受器的信息投射到脊髓及脊髓以上水平中枢神经系统。肾交感传入神经激活是中枢交感神经过度激活的重要原因之一,同时中枢交感神经激活又进一步增高肾脏交感传入神经的活性,因此二者存在密切的相互联系。
RDN是将导管经股动脉路径送达肾动脉,在选定的位置释放射频电流,使肾动脉内膜局部产生高温并传导到外膜,位于肾动脉外膜中的交感神经纤维在高温下变性坏死,从而部分阻断肾交感神经的活性。
2 RDN治疗心房颤动的相关研究
自从1998年法国的Haissagueerre教授[5]在房颤的“驱动”和“多子波折返”说的基础上,结合消融结果提出了“肺静脉波”假说。该假说认为,肺静脉及其周围心房组织是房颤维持的关键部位,从而提出了电隔离肺静脉治疗房颤的消融策略。此后,导管消融在症状性房颤患者治疗中的地位已逐渐得到认可,但如何降低术后房颤的复发率仍是困扰该项技术的主要问题。相关研究证实症状性房颤患者导管消融术后6年的成功率仅为23%[6],其复发率相对较高原因复杂,包括消融术后肺静脉重新恢复电传导、消融过程中未发现非肺静脉起源靶点,同时还与患者年龄、左房内径、房颤持续时间等因素相关[7]。
Zhao等[8]关于肾去神经化后对犬心房快速起搏,诱发房颤持续时间、诱发程度及心房有效不应期等方面的研究表明,肾动脉消融后血管外壁的神经丛存在明显的收缩和凋亡,失去原有的正常组织结构。肾动脉消融以后,心房有效不应期缩短的程度得到有效的控制。同时肾动脉消融组,在心房快速起搏时诱发房颤的持续时间明显较对照组缩短,并且诱发次数也明显低于对照组。Linz等[9]在动物试验模型中证实RDN后可显著降低猪心脏交感神经活性,心脏表现为负性变时和变传导,房室结有效不应期和前向性文氏传导周长的增加,同时有效控制房颤时心室率。在心房快速起搏时RDN组诱发出的房颤时程明显短于对照组,但是二者间房颤诱发窗口无明显差异。后者可能是源于RDN对于心房快速起搏所致的心房有效不应期及房内传导时间缩短没有影响。尽管在Linz[9]的试验中RDN并未改变心房有效不应期,但其对自主神经功能的调节可有效的控制房颤时心室率,甚至可降低房颤的易感性。
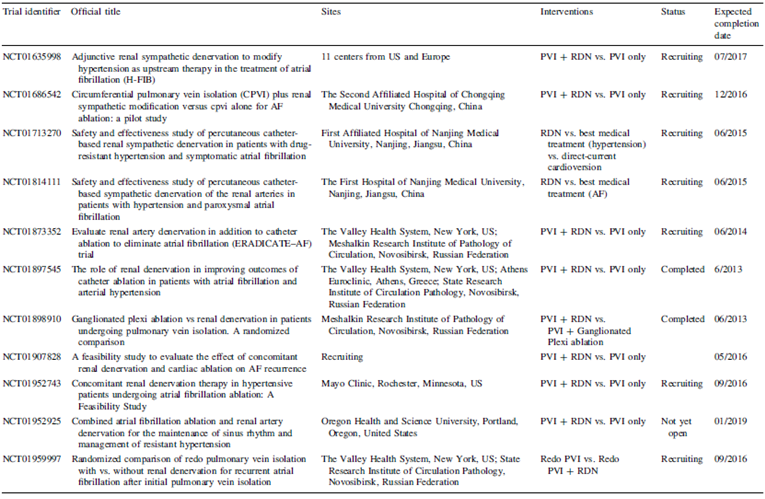
Pokushalov等[10]报道了一个前瞻性、随机RDN和肺静脉隔离(pulmonary veins isolation, PVI)对合并顽固性高血压的房颤患者的影响。27例合并顽固性高血压的阵发性/持续性房颤患者被随机分为单纯PVI组(14例)和RDN+PVI组(13例),术后PVI+RDN组同时影像学证实没有引起肾动脉狭窄,这是RDN安全性的一个重要标志。术后12个月的随访时间内分别观察房颤复发和血压变化情况。结果表明,PVI+RDN组术后窦性心律维持率为69%,显著高于单纯PVI组(29%);同时PVI+RDN组术后收缩压和舒张压下降情况也明显优于单纯PVI组。随后Vollmann等[11]也报道了一例应用RDN替代肺静脉电隔离治疗合并难治性高血压的持续性房颤患者,术后6个月的随访时间内患者均维持窦性心律,房颤未在复发。同时患者的症状及运动耐量得到显著改善,并且患者左房内径也较术前明显下降。近期Pokushalov等[12]在前期的研究基础上又纳入了53例患者进行随机RDN和PVI对合并顽固性高血压房颤患者影响的研究,并结合前期研究结果进行了meta分析。Pokushalov等发现术后窦性心律维持率RDN+PVI组明显高于单纯PVI组(63% vs 41%, P=0.019),进一步亚组分析发现对于合并重度难治性高血压的房颤患者来说RDN+PVI组术后窦性心律维持率明显高于单纯PVI组(61% vs 28%, P=0.03);然而对于合并中度难治性高血压的房颤患者来说RDN+PVI组与单纯PVI组术后窦性心律维持率间无差异(52% vs 65%, P=0.19)。Meta分析证实RDN可降低PVI术后房颤复发风险,持续性房颤、重度难治性高血压患者行RDN+PVI潜在获益可能。此外,目前尚有至少11项[13]关于RDN治疗房颤的临床试验正在进行中(表1)。
急、慢性血压的升高均可促进心房牵张及心房扩张,即心房基质改变,导致心房内电传导不均一性增加从而易于房颤的诱发。目前认为一旦成功完成肺静脉隔离,则最主要的电触发活动即被消除。虽然急、慢性血压升高对肺静脉电触发活动无影响,但在心房基质改变较重的房颤患者中,可能还需要其他干预措施以达到最大化的抗心律失常作用。良好的血压控制有助于PVI术后预防房颤的复发,而RDN恰可较好的控制顽固性高血压患者的血压。此外,RDN后有效减少肾脏传入神经纤维向中枢神经传递神经冲动,进而降低中枢向外周神经系统传导神经冲动。这样可衰减自主神经对房颤的触发作用。可见RDN不仅可有效控制顽固性高血压患者的血压,同时还可预防PVI术后房颤的复发。这一结果令人振奋,Scherlag等[14]认为无论房颤导管消融的方式怎样,即使消融的方式不稳定,在加以RDN后,其预后均得到明显改善。所以不可否认的是RDN对预防房颤的复发潜在一定的疗效,仍需进一步大规模临床试验证实。
自从1998年法国的Haissagueerre教授[5]在房颤的“驱动”和“多子波折返”说的基础上,结合消融结果提出了“肺静脉波”假说。该假说认为,肺静脉及其周围心房组织是房颤维持的关键部位,从而提出了电隔离肺静脉治疗房颤的消融策略。此后,导管消融在症状性房颤患者治疗中的地位已逐渐得到认可,但如何降低术后房颤的复发率仍是困扰该项技术的主要问题。相关研究证实症状性房颤患者导管消融术后6年的成功率仅为23%[6],其复发率相对较高原因复杂,包括消融术后肺静脉重新恢复电传导、消融过程中未发现非肺静脉起源靶点,同时还与患者年龄、左房内径、房颤持续时间等因素相关[7]。
Zhao等[8]关于肾去神经化后对犬心房快速起搏,诱发房颤持续时间、诱发程度及心房有效不应期等方面的研究表明,肾动脉消融后血管外壁的神经丛存在明显的收缩和凋亡,失去原有的正常组织结构。肾动脉消融以后,心房有效不应期缩短的程度得到有效的控制。同时肾动脉消融组,在心房快速起搏时诱发房颤的持续时间明显较对照组缩短,并且诱发次数也明显低于对照组。Linz等[9]在动物试验模型中证实RDN后可显著降低猪心脏交感神经活性,心脏表现为负性变时和变传导,房室结有效不应期和前向性文氏传导周长的增加,同时有效控制房颤时心室率。在心房快速起搏时RDN组诱发出的房颤时程明显短于对照组,但是二者间房颤诱发窗口无明显差异。后者可能是源于RDN对于心房快速起搏所致的心房有效不应期及房内传导时间缩短没有影响。尽管在Linz[9]的试验中RDN并未改变心房有效不应期,但其对自主神经功能的调节可有效的控制房颤时心室率,甚至可降低房颤的易感性。
Pokushalov等[10]报道了一个前瞻性、随机RDN和肺静脉隔离(pulmonary veins isolation, PVI)对合并顽固性高血压的房颤患者的影响。27例合并顽固性高血压的阵发性/持续性房颤患者被随机分为单纯PVI组(14例)和RDN+PVI组(13例),术后PVI+RDN组同时影像学证实没有引起肾动脉狭窄,这是RDN安全性的一个重要标志。术后12个月的随访时间内分别观察房颤复发和血压变化情况。结果表明,PVI+RDN组术后窦性心律维持率为69%,显著高于单纯PVI组(29%);同时PVI+RDN组术后收缩压和舒张压下降情况也明显优于单纯PVI组。随后Vollmann等[11]也报道了一例应用RDN替代肺静脉电隔离治疗合并难治性高血压的持续性房颤患者,术后6个月的随访时间内患者均维持窦性心律,房颤未在复发。同时患者的症状及运动耐量得到显著改善,并且患者左房内径也较术前明显下降。近期Pokushalov等[12]在前期的研究基础上又纳入了53例患者进行随机RDN和PVI对合并顽固性高血压房颤患者影响的研究,并结合前期研究结果进行了meta分析。Pokushalov等发现术后窦性心律维持率RDN+PVI组明显高于单纯PVI组(63% vs 41%, P=0.019),进一步亚组分析发现对于合并重度难治性高血压的房颤患者来说RDN+PVI组术后窦性心律维持率明显高于单纯PVI组(61% vs 28%, P=0.03);然而对于合并中度难治性高血压的房颤患者来说RDN+PVI组与单纯PVI组术后窦性心律维持率间无差异(52% vs 65%, P=0.19)。Meta分析证实RDN可降低PVI术后房颤复发风险,持续性房颤、重度难治性高血压患者行RDN+PVI潜在获益可能。此外,目前尚有至少11项[13]关于RDN治疗房颤的临床试验正在进行中(表1)。
急、慢性血压的升高均可促进心房牵张及心房扩张,即心房基质改变,导致心房内电传导不均一性增加从而易于房颤的诱发。目前认为一旦成功完成肺静脉隔离,则最主要的电触发活动即被消除。虽然急、慢性血压升高对肺静脉电触发活动无影响,但在心房基质改变较重的房颤患者中,可能还需要其他干预措施以达到最大化的抗心律失常作用。良好的血压控制有助于PVI术后预防房颤的复发,而RDN恰可较好的控制顽固性高血压患者的血压。此外,RDN后有效减少肾脏传入神经纤维向中枢神经传递神经冲动,进而降低中枢向外周神经系统传导神经冲动。这样可衰减自主神经对房颤的触发作用。可见RDN不仅可有效控制顽固性高血压患者的血压,同时还可预防PVI术后房颤的复发。这一结果令人振奋,Scherlag等[14]认为无论房颤导管消融的方式怎样,即使消融的方式不稳定,在加以RDN后,其预后均得到明显改善。所以不可否认的是RDN对预防房颤的复发潜在一定的疗效,仍需进一步大规模临床试验证实。
3 结语
心房颤动的发生与心房结构重构、电重构及自主神经功能紊乱息息相关。如果可以通过RDN最大限度的控制自主神经功能紊乱,那么也就可以间接的控制其他与房颤发生相关的因素,进而干预房颤。尽管RDN潜在的血压控制,同时因其对交感神经活性的影响,可能潜在着干预房颤的治疗作用。但由于干预房颤的传导通路较为复杂,干预因素较多,确切的效果仍需更大规模的临床研究证实。可见目前认为RDN对房颤有治疗作用仍为时尚早。
心房颤动的发生与心房结构重构、电重构及自主神经功能紊乱息息相关。如果可以通过RDN最大限度的控制自主神经功能紊乱,那么也就可以间接的控制其他与房颤发生相关的因素,进而干预房颤。尽管RDN潜在的血压控制,同时因其对交感神经活性的影响,可能潜在着干预房颤的治疗作用。但由于干预房颤的传导通路较为复杂,干预因素较多,确切的效果仍需更大规模的临床研究证实。可见目前认为RDN对房颤有治疗作用仍为时尚早。
表1.RDN治疗房颤的相关研究

参考文献
1. January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College ofCardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society[J].Circulation, 2014, 130(23):e199-e267.
2. Krum H, Schlaich M, Whitbourn R, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study[J]. The Lancet, 2009, 373(9671): 1275-1281.
3. A controlled trial of renal denervation for resistant hypertension. Bhatt DL, Kandzari DE, O’Nell WW, et al. N Engl J Med, 2014, 370(15): 1393-1401.
4. Cai L, Yin Y, Ling Z, et al. Predictors of late recurrence of atrial fibrillation after catheter ablation[J]. Int J Cardiol, 2013, 164(1): 82-87.
5. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J].N Engl J Med, 1998, 339(10):659-666.
6. Sorgente A, Tung P, Wylie J, et al. Six year follow-up after catheter ablation of atrial fibrillation: a palliation more than a true cure[J]. Am J Cardiol, 2012, 109(8): 1179-1186.
7. Reichlin T, Michaud GF. Our approach to maximizing the durability of pulmonary vein isolation during a paroxysmal atrial fibrillation ablation procedure[J]. J Cardiovasc Electrophysiol, 2012, 23(11): 1272-1276.
8. Zhao Q, Yu S, Zou M, et al. Effect of renal sympathetic denervation on the inducibility of atrial fibrillation during rapid atrial pacing[J]. Journal of interventional cardiac electrophysiology, 2012, 35(2): 119-125.
9. Linz D, Mahfoud F, Schotten U, et al. Renal sympathetic denervation provides ventricular rate control but does not prevent atrial electrical remodeling during atrial fibrillation[J]. Hypertension, 2013, 61(1): 225-231.
10. Pokushalov E, Romanov A, Corbucci G, et al. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension[J]. Journal of the American College of Cardiology, 2012, 60(13): 1163-1170.
11. Vollmann D, Sossalla S, Schroeter M R, et al. Renal artery ablation instead of pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant, persistent atrial fibrillation[J]. Clinical Research in Cardiology, 2013: 1-4.
12. Pokushalov E, Romanov A, Katritsis DG, et al. Renal denervation for improving outcomes of catheter ablation in patients with atrial fibrillation and hypertension: Early experience[J]. Heart Rhythm, 2014, 11(7): 1131–1138.
13.Linz D, van Hunnik A, Ukena C, et al. Renal denervation: effects on atrial electrophysiology and arrhythmias[J]. Clin Res Cardiol, 2014, 103(10):765-774.
14. Scherlag M A, Scherlag B J. A Randomized Comparison of Pulmonary Vein Isolation With Versus Without Concomitant Renal Artery Denervation in Patients With Refractory Symptomatic Atrial Fibrillation and Resistant Hypertension[J]. Journal of the American College of Cardiology, 2013, 62(12): 1129-1130.
1. January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College ofCardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society[J].Circulation, 2014, 130(23):e199-e267.
2. Krum H, Schlaich M, Whitbourn R, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study[J]. The Lancet, 2009, 373(9671): 1275-1281.
3. A controlled trial of renal denervation for resistant hypertension. Bhatt DL, Kandzari DE, O’Nell WW, et al. N Engl J Med, 2014, 370(15): 1393-1401.
4. Cai L, Yin Y, Ling Z, et al. Predictors of late recurrence of atrial fibrillation after catheter ablation[J]. Int J Cardiol, 2013, 164(1): 82-87.
5. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J].N Engl J Med, 1998, 339(10):659-666.
6. Sorgente A, Tung P, Wylie J, et al. Six year follow-up after catheter ablation of atrial fibrillation: a palliation more than a true cure[J]. Am J Cardiol, 2012, 109(8): 1179-1186.
7. Reichlin T, Michaud GF. Our approach to maximizing the durability of pulmonary vein isolation during a paroxysmal atrial fibrillation ablation procedure[J]. J Cardiovasc Electrophysiol, 2012, 23(11): 1272-1276.
8. Zhao Q, Yu S, Zou M, et al. Effect of renal sympathetic denervation on the inducibility of atrial fibrillation during rapid atrial pacing[J]. Journal of interventional cardiac electrophysiology, 2012, 35(2): 119-125.
9. Linz D, Mahfoud F, Schotten U, et al. Renal sympathetic denervation provides ventricular rate control but does not prevent atrial electrical remodeling during atrial fibrillation[J]. Hypertension, 2013, 61(1): 225-231.
10. Pokushalov E, Romanov A, Corbucci G, et al. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension[J]. Journal of the American College of Cardiology, 2012, 60(13): 1163-1170.
11. Vollmann D, Sossalla S, Schroeter M R, et al. Renal artery ablation instead of pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant, persistent atrial fibrillation[J]. Clinical Research in Cardiology, 2013: 1-4.
12. Pokushalov E, Romanov A, Katritsis DG, et al. Renal denervation for improving outcomes of catheter ablation in patients with atrial fibrillation and hypertension: Early experience[J]. Heart Rhythm, 2014, 11(7): 1131–1138.
13.Linz D, van Hunnik A, Ukena C, et al. Renal denervation: effects on atrial electrophysiology and arrhythmias[J]. Clin Res Cardiol, 2014, 103(10):765-774.
14. Scherlag M A, Scherlag B J. A Randomized Comparison of Pulmonary Vein Isolation With Versus Without Concomitant Renal Artery Denervation in Patients With Refractory Symptomatic Atrial Fibrillation and Resistant Hypertension[J]. Journal of the American College of Cardiology, 2013, 62(12): 1129-1130.