起搏器患者不能接受磁共振成像检查将成为历史
2015-12-31 22:03
美敦力SureScanTM起搏系统兼容全身MRI且无扫描部位限制
随着时代的进步和科技的发展,心脏起搏器成为治疗缓慢性心律失常的最有效方法。在过去的数十年中,世界范围内超过五百万患者接受了起搏器植入。2015年中国大陆预估植入起搏器人数将超过6万人。
但传统心脏起搏器都有一个“软肋”——不能接受磁共振检查(MRI)。两者会相互影响,导致心脏起搏器不能正常工作,甚至可能使导线头端过热造成心内膜灼伤,因此所有起搏器植入患者被禁止接受磁共振检查。专家指出,MRI主要影响起搏器如下功能:造成起搏器或电极发生移位;影响磁控开关;产生热效应;变起搏频率、抑制或触发快速起搏及程序重置;影响电池电压。
因此,不少病人经常会陷入这样两难的境地:不装,不能有效治疗;装了,又不能做核磁共振等检查。
而在接受起搏器治疗后,相当一部分患者可能需要接受MRI检查。有研究发现,50%~75%的起搏器植入患者一生中可能需要进行MRI扫描。而根据流行病学统计,年龄大于65岁的患者需要进行MRI检查的几率更是成倍增加。
相对其它检查手段,由于没有电离辐射,同时兼具了多方位成像、对解剖结构细节显示较好以及优越的组织分辨率等优势,MRI扫描在诊断癌症、骨关节疾病、大脑、脊髓及复杂先天性心脏畸形等方面的作用具有不可企及和替代的优势。
因此,在这样的大背景下,近年来,让起搏系统兼容MRI成为起搏器研究的新方向,MRI兼容起搏器研发加速,临床应用也不断取得突破。
1997年,美敦力率先启动兼容MRI起搏系统的研究——2,000,000以上的测试模型;464例患者入组的临床试验
2008年,临床试验完毕,第一代SureScanTM技术获得CE 认证,次年(2009年)第二代SureScanTM 起搏系统获得CE认证,从而开启了兼容全身MRI扫描时代!
2010年, Advisa DR MRITM SureScanTM植入式心脏起搏器 获得SFDA批准,为心律失常患者提供业界领先的疾病管理解决方案
2011年,SureScanTM起搏系统获得美国FDA批准,全球第一款兼容全身MRI起搏电极导线5086MRI获得SFDA批准。
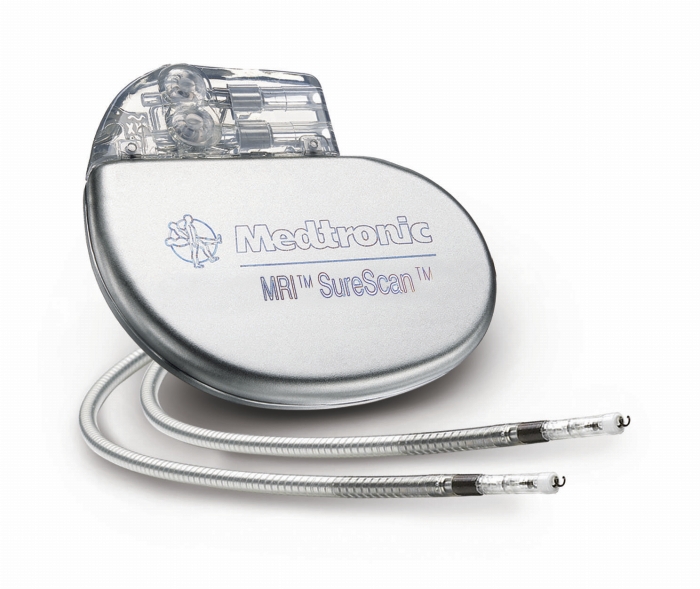
全球第一款兼容全身MRI 的SureScanTM起搏系统
德国Biotronik公司也研发了ProMRI系统、美国ST.Jude公司的MRI-conditional兼容起搏系统、美国Boston Scientific公司的ImageReady MRI系统陆续上市,其它国内外起搏器生产企业也逐渐聚焦该领域。MRI兼容起搏器渐渐成为起搏适应症合并高MRI检查风险患者优选。
需要注意的是,国内上市Biotronik公司的ProMRI起搏器系统仍存在扫描部位的限制,而美敦力公司的SureScanTM起搏系统(含起搏器和电极)兼容全身MRI且无扫描部位限制。
新一代MRI兼容性起搏器的问世,使该患者群从“MRI不安全”向“MRI条件性安全”迈出重要的一步,为依赖MRI进行诊断的患者带来了福音。对于65岁以上起搏器适应证患者,若其既往有MRI检查史,或合并脑卒中、肿瘤和骨关节病等疾病或高危因素,则应考虑植入MRI兼容性起搏器。
需要说明的是,目前,起搏器患者仍只限于接受1.5 T以下的MRI检查,3.0 T MRI检查尚存在安全隐患。并且1.5 T通常可满足绝大部分患者临床需求。随着3.0 T MRI(信噪比高于1.5 T)的广泛应用,其在成像质量、成像速度、频谱诊断和水成像等特殊显像的优势也日渐突出,可获得更好的心血管、骨关节和脑功能成像。如何解决这一新形势下的挑战,这将成为未来MRI兼容性起搏器在技术层面和临床研究方面探索的又一方向。